
【题目】某学生用0.1200mol/LNaOH溶液测定某未知浓度的盐酸溶液,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是用序号字母填写:__→__→F→__→__→__→D。
(2)操作F中应该选择图中滴定管___填标号。

(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察__。
(4)滴定结果如表所示:
滴定次数 | 待测液体积 | 标准溶液的体积 | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 0.60 | 20.60 |
3 | 25.00 | 0.20 | 20.19 |
计算该盐酸的物质的量浓度为__(精确至0.001)。
(5)下列操作会导致测定结果偏高的是__。
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(6)氧化还原滴定实验与酸碱中和滴定类似用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
Ⅰ、写出用KMnO4滴定H2C2O4的离子方程式__。
Ⅱ、判断滴定终点的方法是__
【答案】E A B C G 乙 锥形瓶内溶液颜色的变化 0.120molL-1 AD 2MnO4-+ 5H2C2O4 + 6H+ = 10CO2 + 2Mn2+ + 8H2O 当滴入最后一滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不褪色
【解析】
⑴酸碱中和滴定顺序是查漏、洗净、润洗、装液、排气泡、调液面、读记数据、待测液加锥形瓶、加指示剂、滴定、重复实验。
⑵操作F中是加氢氧化钠溶液。
⑶滴定时边滴边摇动锥形瓶,眼睛应注意观察锥形瓶。
⑷先计算三次平均值,再根据浓度进行计算。
⑸根据c(待测)=![]() 进行误差分析。
进行误差分析。
⑹KMnO4滴定H2C2O4反应生成CO2、Mn2+;高锰酸钾进行滴定时,不需要另外的指示剂,高锰酸钾本身可以做指示剂。
⑴酸碱中和滴定顺序是查漏、洗净、润洗、装液、排气泡、调液面、读记数据、待测液加锥形瓶、加指示剂、滴定、重复实验。因此正确操作的顺序是用序号字母填写:E→A→F→B→C→G→D;
故答案为:E;A;B;C;G。
⑵操作F中是加氢氧化钠溶液,应该用碱式滴定管,因此图中滴定管乙;故答案为:乙。
⑶滴定时边滴边摇动锥形瓶,眼睛应注意观察锥形瓶内溶液颜色的变化;
故答案为:锥形瓶内溶液颜色的变化。
⑷三次滴定,消耗标准溶液的体积分别为20.01mL、20.00mL、19.99mL,平均值为20.00mL,因此该盐酸的物质的量浓度![]() ;
;
故答案为:0.120molL-1。
⑸
A.碱式滴定管在装液前未用标准NaOH溶液润洗,消耗标准液体积偏多,测定结果偏高,故A符合题意;
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出,待测液溶质减少,消耗标准液减少,测定结果偏低,故B不符合题意;
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡,标准液读出数据偏小,测定结果偏低,故C不符合题意;
D.达到滴定终点时,仰视读数,读出数据偏高,测定结果偏高,故D符合题意;
综上所述,答案为AD。
⑹Ⅰ、KMnO4滴定H2C2O4反应生成CO2、Mn2+,其离子方程式2MnO4- + 5H2C2O4 + 6H+ = 10CO2 + 2Mn2+ + 8H2O;
故答案为:2MnO4-+5H2C2O4 + 6H+ = 10CO2 + 2Mn2+ + 8H2O。
Ⅱ、高锰酸钾进行滴定时,不需要另外的指示剂,高锰酸钾本身可以做指示剂,因此判断滴定终点的方法是当滴入最后一滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不褪色;
故答案为:当滴入最后一滴酸性KMnO4溶液后溶液由无色变为浅紫色,且半分钟内不褪色。


科目:高中化学 来源: 题型:
【题目】百服宁口服液为解热镇痛药,主要用于治疗头痛、发烧。其主要化学成分的结构简式为
![]()
下列说法正确的是( )
A.该有机物的分子式为C8H10NO2
B.该有机物属于α-氨基酸
C.含有苯环且属于α-氨基酸的该有机物的同分异构体只有1种
D.该有机物不能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、N、S 的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)CO2 的重整用 CO2 和 H2 为原料可得到 CH4 燃料。
已知: ①CH4 (g)+CO2(g)=2CO(g)+2H2(g) △H1=+247kJ/mol
②CH4 (g)+H2O(g)=CO(g)+3H2(g) △H2=+205kJ/mol
写出 CO2 重整的热化学方程式:_____。
(2) “亚碳酸盐法”吸收烟中的 SO2
①将烟气通入 1.0mol/L 的 Na2SO3 溶液,若此过程中溶液体积不变,则溶液的 pH 不断_____(填“减小”“不变” 或“增大)。当溶液 pH 约为 6 时,吸收 SO2 的能力显著下降,应更换吸收剂,此时溶液中 c(SO32-) =0.2mol/L, 则溶液中 c(HSO3-) =_____。
②室温条件下,将烟气通入(NH4)2SO3 溶液中,测得溶液 pH 与各组分物质的量分数的变化关系如图: b 点时溶液 pH=7,则 n(NH4+):n(HSO3—)= ______________ 。

(3)催化氧化法去除 NO。一定条件下,用 NH3 消除 NO 污染,其反应原理4NH3+6NO![]() 5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为 4:1、3:1、1:3 时,得到 NO 脱除率曲线如图所示:
5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为 4:1、3:1、1:3 时,得到 NO 脱除率曲线如图所示:

①曲线 a 中,NO 的起始浓度为6×10-4mg·m-3,从 A 点到 B 点经过0.8s,该时间段内 NO 的脱除速率为_____mg·m-3·s-1。
②曲线 b 对应 NH3 与 NO 的物质的量之比是_____。
(4)间接电化学法除 NO。其原理如图所示:写出阴极的电极反应式(阴极室溶液呈酸性)_____。吸收池中除去 NO 的原理_____(用离子方程式表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷催化裂化时碳链按两种方式断裂,生成两种烷烃和两种烯烃。如果丁烷的裂化率为60%,且裂化生成的两种烯烃物质的量相等,则裂化后得到的含氢质量分数最高的气体占混合气体的体积分数为
A. 18.75% B. 30% C. 15% D. 22.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时将10mLpH=11的氨水加水稀释至100mL,下列判断正确的是
A.稀释后溶液的pH=7B.氨水的电离度增大,溶液中所有离子的浓度均减小
C.稀释过程中![]() 增大D.pH = 11氨水的浓度为0.001mol/L
增大D.pH = 11氨水的浓度为0.001mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为![]() 的有机物A具有如下性质:
的有机物A具有如下性质:![]() 在浓硫酸作用下,发生分子内脱水生成唯一的有机物B,B能使溴的四氯化碳溶液褪色;
在浓硫酸作用下,发生分子内脱水生成唯一的有机物B,B能使溴的四氯化碳溶液褪色;![]() 在浓硫酸作用下,A能分别与丙酸和乙醇反应生成C和D;
在浓硫酸作用下,A能分别与丙酸和乙醇反应生成C和D;![]() 在浓硫酸作用下,能生成一种分子式为
在浓硫酸作用下,能生成一种分子式为![]() 的五元环状化合物E。下列叙述正确的是
的五元环状化合物E。下列叙述正确的是 ![]()
![]()
A.A的结构简式为![]()
B.C与D互为同系物
C.A转化为B的反应属于取代反应
D.B与E互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中A、B、C、D、E、F、G均为有机化合物。根据如图所示转化关系回答下列问题:
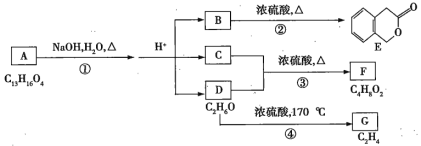
(1)D的化学名称是___________________。
(2)反应③的化学方程式是______________________________________________________。
(3)B的分子式是_________,A的结构简式是_________。反应①的反应类型是_________。
(4)符合下列两个条件的B的同分异构体(不包括B)有_________种。
①与B有相同官能团且苯环上只有两个取代基 ②不与![]() 溶液发生显色反应
溶液发生显色反应
写出其中任意一种同分异构体的结构简式:_______________。
(5)反应④的化学方程式是_________________________________________________________________。G是重要的工业原料,用化学方程式表示G形成高聚物的反应:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氨酯类高分子材料PU用途广泛,其合成反应为:

下列说法不正确的是
A. HO(CH2)4OH的沸点高于CH3CH2CH2CH3
B. 高分子材料PU在强酸、强碱中能稳定存在
C. 合成PU的两种单体的核磁共振氢谱中均有3个吸收峰
D. 以1,3-丁二烯为原料,可合成HO(CH2)4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂是制作电池的材料,其制备过程可以简化成如图所示。下列说法错误的是( )
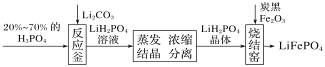
A.蒸发需要的硅酸盐材料仪器有:烧杯、酒精灯、玻璃棒、泥三角
B.反应釜中反应的化学方程式为2H3PO4+Li2CO3=2LiH2PO4+H2O+CO2↑
C.分离的操作是过滤
D.烧结窑中氧化铁与炭黑发生氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com