
| A. | Br2>Fe3+>I2 | B. | I->Fe2+>Br- | C. | Br2>I2>Fe3+ | D. | Fe3+>I2>Br2 |
分析 根据反应中元素化合价的降低来分析氧化剂,然后利用氧化剂的氧化性大于氧化产物的氧化性来比较.
解答 解:反应①中Fe元素的化合价由+3降低为+2价,则Fe3+为氧化剂,I元素的化合价从-1价升高为0价,所以I2是氧化产物,由氧化剂的氧化性大于氧化产物的氧化性,则氧化性Fe3+>I2,
反应②中Br元素的化合价由0降低为-1价,则Br2为氧化剂,Fe元素的化合价由+2升高为+3价,则Fe3+为氧化剂,由氧化剂的氧化性大于氧化产物的氧化性,则氧化性Br2>Fe3+,由以上反应可知氧化性强弱为Br2>Fe3+>I2,
故选A.
点评 本题考查氧化性的比较,明确氧化还原反应中元素的化合价变化及氧化剂的氧化性大于氧化产物的氧化性是解答本题的关键.


科目:高中化学 来源: 题型:选择题
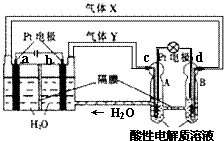 “天宫一号”RFC供电系统是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图,有关说法正确的是( )
“天宫一号”RFC供电系统是一种将水电解技术与氢氧燃料电池技术相结合的可充放电池.如图为RFC工作原理示意图,有关说法正确的是( )| A. | 当转移0.1 mol电子,a极产生2.24 L H2 | |
| B. | b电极反应是:4H2O+4e-═2H2↑+4OH- | |
| C. | d电极反应是:O2+4H++4e-═2H2O | |
| D. | c极上发生还原反应,B中H+经隔膜进入A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硬水、软水(肥皂水) | B. | 稀盐酸、食盐水(酚酞试液) | ||
| C. | 涤纶、羊毛制品(点燃) | D. | 空气、氧气(带火星的木条) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
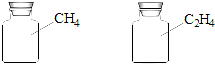
| A. | 所含原子数相等 | B. | 所含氢原子数相等 | ||
| C. | 所含分子数相等 | D. | 气体密度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3v正(N2)=v正(H2) | B. | v正(N2)=v逆(NH3) | C. | 2v正(H2)=3v逆(NH3) | D. | v正(N2)=3v逆(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硝酸盐是还原剂 | B. | 维生素C是还原剂 | ||
| C. | 维生素C是氧化剂 | D. | 亚硝酸盐被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 Fe(OH)3+3H+,过量盐酸抑制FeCl3水解(结合离子方程式简要说明).
Fe(OH)3+3H+,过量盐酸抑制FeCl3水解(结合离子方程式简要说明).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com