
| A、标准状况下,5.6L四氯化碳含有的分子数为0.25NA |
| B、标准状况下,14g氮气含有的核外电子数为5NA |
| C、足量Zn与一定量的浓硫酸反应,产生标准状况下22.4L气体,转移的电子数为2NA |
| D、标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA |


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
| A、H-是很强的氧化剂 |
| B、NH3具有还原性 |
| C、该反应的还原产物和氧化产物都是H2 |
| D、该反应属于置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入足量的盐酸无明显现象,再加入BaCl2溶液,产生白色沉淀 | 原溶液中一定含有SO42- |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该溶液中一定含有CO32- |
| D | 用铂丝蘸取某溶液在无色火焰上灼烧直接观察火焰颜色未见紫色 | 原溶液中不含K+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠与水反应:Na+H2O=Na++OH-+H2↑ |
| B、铁和稀硝酸反应:Fe+2H+=H2↑+Fe2+ |
| C、向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
| D、NaHCO3溶液与HCl溶液反应:H++HCO3-=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Na2SO4溶于水中,所得溶液中Na+个数为NA |
| B、18g水含有电子数为8NA |
| C、1L 0.3mol?L-1 Na2SO4溶液中,含有Na+和SO42-总数为0.6NA |
| D、NA个氢气分子(H2)的质量为2g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
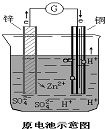 如图所示原电池中,
如图所示原电池中,查看答案和解析>>
科目:高中化学 来源: 题型:
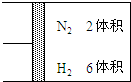 如图所示,在一定温度下,把2体积N2和6体积H2通入一个带有活塞的容积可变的容器中,活塞的一端与大气相通,容器中发生以下反应:N2+3H2?2NH3(正反应放热),若反应达到平衡后,测得混合气体的体积为7体积.据此回答下列问题:
如图所示,在一定温度下,把2体积N2和6体积H2通入一个带有活塞的容积可变的容器中,活塞的一端与大气相通,容器中发生以下反应:N2+3H2?2NH3(正反应放热),若反应达到平衡后,测得混合气体的体积为7体积.据此回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
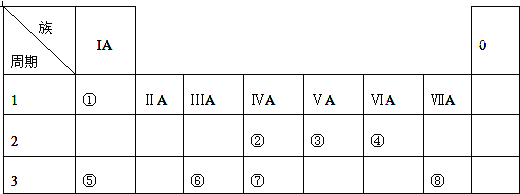
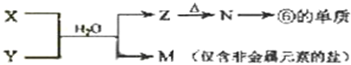
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com