
��1�������������壨FeSO4��7H2O����ҽҩ������Ѫ����ʵ����ͨ������ʵ���ɷ���м�Ʊ�FeSO4��7H2O���壺
a.��5% Na2CO3��Һ���뵽ʢ��һ��������м���ձ��У����������ӣ�����������ȥNa2CO3 ��Һ��Ȼ����м��ˮϴ��2��3�飻
��Һ��Ȼ����м��ˮϴ��2��3�飻
b.��ϴ�ӹ��ķ���м�м��������ϡ���ᣬ�����¶���50��80��֮������м�ľ���
c.���ȹ��ˣ�����Һת�뵽�ܱ������У����á���ȴ�ᾧ��
d.���ᾧ��Ϻ��˳����壬��������ˮϴ��2��3�Σ�������ֽ���������ɣ�
e.���Ƶõ�FeSO4��7H2O�������һ��С���ƿ�У��ܱձ��档��ش��������⣺
��ʵ�鲽��b���Բ������������� ��
��ʵ�鲽��d����������ˮϴ�Ӿ��壬��Ŀ���� �� ��
��2�����������Ϻ��֣����������ڲ�ͬ�¶��½ᾧ�ɷֱ�õ�FeSO4��7H2O��FeSO4��4H2O��FeSO4��H2O�����������ڲ�ͬ�¶��µ��ܽ�Ⱥ��¶������������������±���ʾ������56.7�桢64���¶��¿�ͬʱ�������־��壩�������������ܽ�Ⱥ�������������
�¶�/�� | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
�ܽ��/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
�������� | FeSO4��7H2O | FeSO4��4H2O | FeSO4��H2O | |||||||||
����ݱ����������������������ܽ�����ߡ�
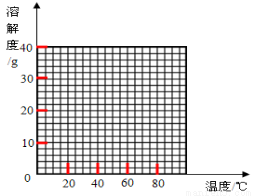
��3�����������������Һ�нᾧ��FeSO4��4H2O��Ӧ���ƵĽᾧ�¶ȣ�t���ķ�ΧΪ ��
 ��4�������������壨FeSO4��7H2O����ҽҩ������Ѫ����ij����С��ⶨ�ò�Ѫ������Ԫ�صĺ�����ʵ�鲽�����£�
��4�������������壨FeSO4��7H2O����ҽҩ������Ѫ����ij����С��ⶨ�ò�Ѫ������Ԫ�صĺ�����ʵ�鲽�����£�
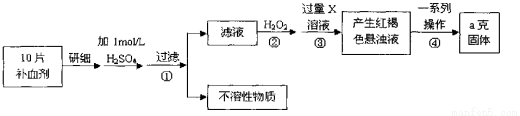
��ش��������⣺
��֤���������Һ�к���Fe2+�ķ������ȵμ�KSCN��Һ���ٵμ� ���ù��̵�����Ϊ�� ��
�ڲ������һϵ�д����IJ������裺���ˡ� �����ա� ��������
����ʵ������ģ���ÿƬ��Ѫ������Ԫ�ص����� g��
�ܸ�С����Щͬѧ��Ϊ������KMnO4��Һ�ζ�Ҳ�ܽ�����Ԫ�أ�Fe2+�������IJⶨ����д���÷�Ӧ�Ļ�ѧ����ʽ ��
 ��ǰ�κ�ͬ����ϰϵ�д�
��ǰ�κ�ͬ����ϰϵ�д� ����С��ҵϵ�д�
����С��ҵϵ�д� �Ƹ�С״Ԫ����������ϰ��ϵ�д�
�Ƹ�С״Ԫ����������ϰ��ϵ�д� �ɹ�ѵ���ƻ�ϵ�д�
�ɹ�ѵ���ƻ�ϵ�д� ����ѵ����ֱͨ�п�����ϵ�д�
����ѵ����ֱͨ�п�����ϵ�д� һ���㶨ϵ�д�
һ���㶨ϵ�д� ��У��ҵ��ϵ�д�
��У��ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���㽭ʡ�߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
���Ҵ���ȡ�Ҷ����Ҷ��������������;��˳����ȷ����
��ȡ����Ӧ �ڼӳɷ�Ӧ ��������Ӧ �ܻ�ԭ��Ӧ ����ȥ��Ӧ ��������Ӧ ���кͷ�Ӧ �����۷�Ӧ
A���ݢڢ٢ۢ� B���٢ڢۢܢݢ� C���ݢڢ٢ۢ� D���٢ڢݢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���㽭ʡ��һ�����л�ѧ�Ծ��������棩 ���ͣ�ʵ����
1��2����������������Ϳ����������Ӽ���������������ɫҺ�壬�ܶ���2.18g/cm3���е�131.4�棬�۵�9.79�棬������ˮ�������ڴ����ѡ���ͪ���л��ܼ�����ʵ���п�������ͼ��ʾװ���Ʊ�1��2���������顣���з�Һ©������ƿa��װ���Ҵ���Ũ����Ļ��Һ���Թ�d��װ��Ũ��ˮ�����渲������ˮ����
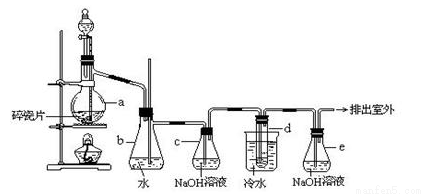
����д���пհף�
��1����ƿa�з��������Ҵ�����ˮ��Ӧ������ȥ��Ӧ����Ӧ�¶���170�棬���Ҹ÷�ӦҪ���¶�Ѹ�����ߵ�170�棬��������������Ӧ����д���Ҵ�������ȥ��Ӧ�ķ���ʽ ��
��2��д���Ʊ�1��2����������Ļ�ѧ����ʽ�� ��
��3����ȫƿb���Է�ֹ�����������Լ��ʵ�����ʱ�Թ�d�Ƿ�����������ش�������ʱƿb�е����� ��
��4������c��NaOH��Һ�������ǣ� ��
��5���жϸ��Ʊ���Ӧ�Ѿ��������������___________________________��
��6�������������������������ѣ�����__________�ķ�����ȥ��
��7����Ӧ������Ӧ����ˮ��ȴװ��d������ҪĿ����___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���㽭ʡ��һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��������������NaOH��Һ��Na2CO3����ˮ����������Һ�ͼ״�����Ӧ����( )
A��C6H6 B��CH3CHO C��CH3COOH D��CH2=CH��COOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���㽭ʡ��һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
ƻ��iPad��iPhone�����й���������137��ƻ����˾פ�й���Ӧ������Ա����ȴ���ڱ�¶�������黷���У��������ܲ���Ӱ�졣ijͬѧ�����е�ߵͽ�������������(��֪����5�������Ѱ��е��ɵ͵���˳������)��������������ܲ����λ����( )
�� | �� | �� | �� | �� |
���� | ��ϩ | ���� | 2�������� | �ױ� |
A���ۢ� ֮�� B���ڢ�֮�� C���ܢ�֮�� D����֮��
֮�� B���ڢ�֮�� C���ܢ�֮�� D����֮��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���㽭ʡ�߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ������ܹ��ɹ�����( )
A��������Һ�е�SO����Һ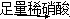 ����
����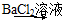 ��ɫ����
��ɫ����
B����ȥ���������л��е�������Һ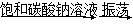 ��Һ�ֲ�
��Һ�ֲ�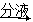 ���ϲ�Һ��
���ϲ�Һ��
C��֤������������H2O2�����Ա�I2ǿ��NaI��Һ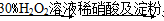 ��Һ����ɫ
��Һ����ɫ
D��������A�ijɷ���FeBr3��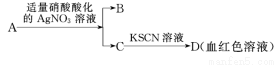
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���㽭ʡ�߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
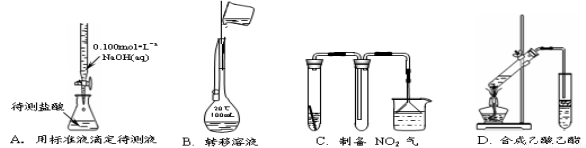
����ʵ��װ����ƻ�����϶������ ( )
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���㽭��Ҧ��ѧ��һʵ��������л�ѧ�Ծ��������棩 ���ͣ������
�۲������Ԫ�����ڱ������ش���������

��1��������Ԫ�����ڱ��У�ȫ���ǽ���Ԫ�ص�����Ϊ ��
�� �� �� ��
��2����ʵ����������ǽ����ķֽ��ߡ����ڴ����ͼ����ɣ�
��3�����ʣ����â٢ڢ�����Ԫ�� ����ܡ����� �����γ����ӻ�������ܣ���д�������ʵ�����_________�������ܣ��˸��
�����γ����ӻ�������ܣ���д�������ʵ�����_________�������ܣ��˸��
�������ģ�ͱ�ʾ�ٺ͢��γɵĻ�����ķ��ӽṹ��Ӧ���� ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й�ʵ���������������۶���ȷ���ǣ� ��
ѡ�� | ʵ����������� | ʵ����� |
A | �ⶨ�����ʵ���Ũ�ȵ�Na2SO4��Na2CO3��Һ��PH�����߽�С | �ǽ����ԣ�S��C |
B | ����֧ʢ��KI3��Һ���Թ��зֱ�μӵ�����Һ��AgNO3��ǰ�߱����������л�ɫ���� | KI3��Һ�д���ƽ�� I3- |
C | BaSO4������Һ�м��뱥��Na2CO3��Һ�а�ɫ���� | ˵��Ksp(BaSO4)����Ksp(BaCO3) |
D | ��ij����Һ���ȵ�����ˮ�������KSCN��Һ����Һ����Ѫ��ɫ | �ô���Һ��һ������Fe2�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com