
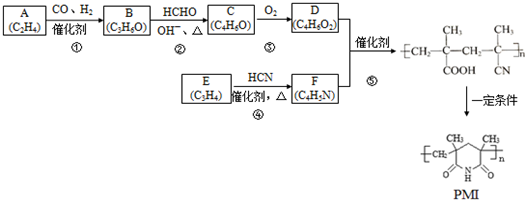
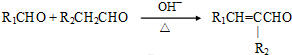 (注:R1可以是烃基本,也可以是H原子)
(注:R1可以是烃基本,也可以是H原子)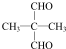 .
.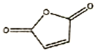 和
和 反应可制备
反应可制备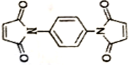 .然后以
.然后以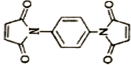 为单体发生聚合反应可合成另一种聚亚酰胺树脂X.该聚合反应的化学方程式为:n
为单体发生聚合反应可合成另一种聚亚酰胺树脂X.该聚合反应的化学方程式为:n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$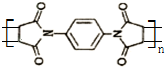 (X中无碳碳双键)
(X中无碳碳双键) 分析 由分子式可知A为CH2=CH2,由信息①可知B为CH3CH2CHO,B与HCHO发生信息②中的反应生成C,结合C的分子式可知,C的结构简式为CH2=C(CH3)CHO,C发生催化氧化生成D为CH2=C(CH3)COOH,F的核磁共振氢谱有两种化学环境的氢,其峰面积之比为2:3,结合反应⑤的产物结构可知F为CH2=C(CH3)CN,E为CH≡CCH3.
解答 解:由分子式可知A为CH2=CH2,由信息①可知B为CH3CH2CHO,B与HCHO发生信息②中的反应生成C,结合C的分子式可知,C的结构简式为CH2=C(CH3)CHO,C发生催化氧化生成D为CH2=C(CH3)COOH,F的核磁共振氢谱有两种化学环境的氢,其峰面积之比为2:3,结合反应⑤的产物结构可知F为CH2=C(CH3)CN,E为CH≡CCH3.
(1)A为CH2=CH2,名称是乙烯,B为CH3CH2CHO,含有的官能团是醛基,
故答案为:乙烯;醛基;
(2)由上述分析可知,E的结构简式是CH≡CCH3,④是CH≡CCH3与HCN发生加成反应生成CH2=C(CH3)CN,
故答案为:CH≡CCH3;加成反应;
(3)C的结构简式是CH2=C(CH3)CHO,与新制Cu(OH)2反应的化学方程式:CH2=C(CH3)CHO+2Cu(OH)2$\stackrel{△}{→}$CH2=C(CH3)COOH+Cu2O↓+2H2O,
故答案为:CH2=C(CH3)CHO+2Cu(OH)2$\stackrel{△}{→}$CH2=C(CH3)COOH+Cu2O↓+2H2O,
(4)D为CH2=C(CH3)COOH,D的同系物G比D相对分子质量多14.G比D多一个CH2原子团,G的同分异构体中,能发生银镜反应,说明含有醛基,且1mol G恰好消耗4mol Ag(NH3)2OH,则含有2个醛基,可看作丙烷中H原子被2个-CHO取代,其中一个-CHO取代甲基中H原子时,另外的-CHO有3种位置,也可以是2个-CHO都取代亚甲基中H原子,故共有4种,其中一种同分异构体的核磁共振氢谱只呈现2个吸收峰,其结构简式为 ,
,
故答案为:4; ;
;
(5)若高分子化合物PMI的平均相对分子质量为10000,其链节组成为C8H11O2N,则n的数值近似为 $\frac{1000}{12×8+11+32+14}$=65,
故选:B;
(6) 为单体发生聚合反应可合成另一种聚亚酰胺树脂X(X中无碳碳双键),该聚合反应的化学方程式为:n
为单体发生聚合反应可合成另一种聚亚酰胺树脂X(X中无碳碳双键),该聚合反应的化学方程式为:n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ ,
,
故答案为:n $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ .
.
点评 本题考查有机物的推断与合成、有机反应类型、有机反应方程式书写、限制条件同分异构体书写等,较好的考查学生自学能力、信息获取能力与知识迁移运用能力,是对有机化学基础综合考查.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
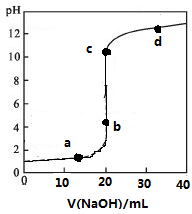 常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的PH与氢氧化钠溶液体积V的关系如图所示.下列说法不正确的是( )
常温下,向20mL0.1mol/L某酸HR溶液中滴加0.1mol/L氢氧化钠溶液,溶液的PH与氢氧化钠溶液体积V的关系如图所示.下列说法不正确的是( )| A. | 可选酚酞或甲基橙作指示剂 | |
| B. | 滴定前HR溶液中存在大量HR分子 | |
| C. | V=20 mL时,溶液中水电离的:c(H+)×c(OH-)=1×10-14mol2/L2 | |
| D. | c点时溶液中离子浓度大小关系有c(Na+)>c(R-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
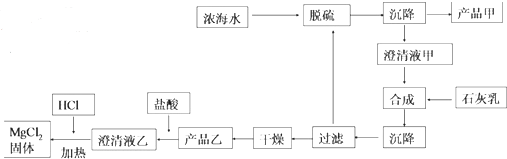
| 离子 | Na+ | Mg2+ | Cl- | SO${\;}_{4}^{2-}$ |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)=c(HA-)+2c(A2-)+c(OH-) | |
| B. | c(H2A)+c(HA-)+c(A2-)=0.1 mol•L-1 | |
| C. | 将上述溶液稀释至0.01mol/L,c(H+)•c(OH-) 不变 | |
| D. | c (A2-)+c (OH-)=c (H+)+c (H2A) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
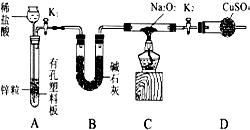
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
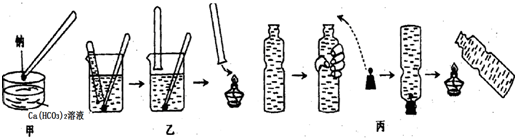
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
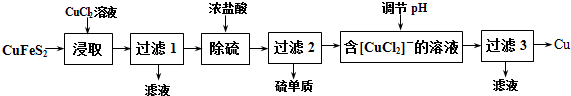
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液加热蒸干最终得不到氯化铁固体 | |
| B. | 用热的纯碱溶液清洗油污效果好 | |
| C. | 在H2、I2和HI组成的平衡体系加压后,混合气体颜色变深 | |
| D. | 常温下,将1 mL pH=3的醋酸溶液加水稀释至100 mL,测得其pH<5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com