

| ||
| ||
| ||
| ||


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
| A、150mL 3mol?L-1 NaCl溶液 |
| B、75mL 2mol?L-1 NaNO3溶液 |
| C、150mL 2mol?L-1 Na2SO4溶液 |
| D、75mL 1mol?L-1的Na2S溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 |
| B、密度:CCl4>CHCl3>H2O>苯 |
| C、同质量的物质燃烧耗O2量:丙炔>乙烷>乙烯>乙炔>甲烷 |
| D、同物质的量物质燃烧耗O2量:已烷>环已烷>苯>苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |

c(HC
| ||
c(C
|
| O | - 3 |
| O | 2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到澄清石灰水先变浑浊后澄清的现象,但通入SO2没有看到澄清石灰水变浑浊的现象.经过思考分析后,该同学改用图二装置,将气体收集在注射器中,缓慢地将两种气体分别通入澄清石灰水中,都能看到澄清石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2产生的现象快.
某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2时可以看到澄清石灰水先变浑浊后澄清的现象,但通入SO2没有看到澄清石灰水变浑浊的现象.经过思考分析后,该同学改用图二装置,将气体收集在注射器中,缓慢地将两种气体分别通入澄清石灰水中,都能看到澄清石灰水先变浑浊再澄清的现象,且通入SO2产生的现象明显比通入CO2产生的现象快.查看答案和解析>>
科目:高中化学 来源: 题型:
A、原混合液中n(N
| ||
B、原混合液中c(S
| ||
| C、原混合液中pH=1-lg1.2 | ||
| D、溶解的Fe粉质量为2.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 分类标准 | 归类 |
| A | FeSO4,NO2,MnO2,NaClO,Cu3P,Na2O2 | H2SO3 |
| B | CH3COOH,HOOC-COOH,HClO,H2S | HF |
| C | 复分解反应、电解反应、放热反应、离子反应 | 焰色反应 |
| D | (NH4)SO4,NH4Cl,NH4NO3,NH3?H2O | NH4HCO3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、 |
D、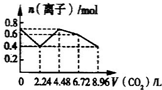 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol的2H35Cl含中子数为1.8NA |
| B、16g O3和O2混合物中氧原子数为NA |
| C、常温下,1L pH=l的溶液中H+的数目大于0.1NA |
| D、0.1 mol的H2O2中含有非极性键数为0.2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com