
| A. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| B. | 可以用澄清石灰水鉴别SO2和CO2 | |
| C. | SO2能使酸性KMnO4水溶液褪色,是因为SO2有漂白性 | |
| D. | 铁粉与过量硫粉反应生成硫化亚铁 |
分析 A.硫与氧气反应只生成二氧化硫;
B.二氧化硫和二氧化碳都能使澄清石灰水变浑浊,气体过量时沉淀都溶解;
C.二氧化硫与酸性高锰酸钾发生氧化还原反应;
D.S具有弱氧化性,与铁反应生成硫化亚铁.
解答 解:A.硫与氧气反应只生成二氧化硫,二氧化硫与氧气在催化剂条件下生成SO3,故A错误;
B.二氧化硫和二氧化碳都能使澄清石灰水变浑浊,气体过量时沉淀都溶解,所以不能用澄清石灰水鉴别二氧化碳和二氧化硫,可以用品红溶液检验二者,故B错误;
C.二氧化硫与酸性高锰酸钾发生氧化还原反应,反应中二氧化硫表现还原性,故C错误;
D.S具有弱氧化性,无论硫是否过量,与铁反应生成硫化亚铁,故D正确.
故选D.
点评 本题综合考查元素化合物知识,为高考常见题型,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
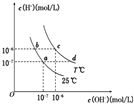 在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件关于离子共存说法中正确的是( )| A. | a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42- | |
| B. | b点对应的溶液中大量存在:Fe2+、Ba2+、K+、NO3- | |
| C. | c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Al3+ | |
| D. | d点对应的溶液中大量存在:Na+、K+、ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫的还原性 | B. | 硫的氧化性 | ||
| C. | 二氧化硫的还原性 | D. | 二氧化硫的漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向乙酸乙酯中加入足量的30%NaOH溶液,在加热的条件下观察酯层的消失 | |
| B. | 乙醇与浓硫酸混合,加热至140℃制取乙烯 | |
| C. | 向2mL的甲苯中加入3滴KMnO4酸性溶液,用力振荡,观察溶液颜色褪去 | |
| D. | 1 mol•L-1CuSO4溶液2 mL和0.5mol•L-1NaOH溶液2mL混合后加入40%的乙醛溶液0.5mL,加热煮沸观察砖红色沉淀的生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1个N≡N键断裂的同时,有2个N-H键断裂 | |
| B. | 3V正(N2)=V逆(H2) | |
| C. | 容器内混合气体的密度不再变化 | |
| D. | 容器内N2、H2、NH3的浓度比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 应用高效洁净的能源转换技术,推广使用节能环保材料 | |
| B. | 大力发展火力发电,解决电力紧张问题 | |
| C. | 研发以高纯硅为核心材料的光伏发电技术 | |
| D. | 大力开发新能源,如核能、太阳能、风能等,减少化石能源的使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ClO3->BrO3->Cl2>Fe3+>I2 | B. | BrO3->Cl 2>ClO3->I2>Fe3+ | ||
| C. | BrO3->ClO3->Cl2>Fe3+>I2 | D. | BrO3->ClO3->Fe3+>Cl2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
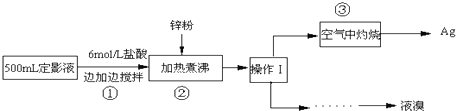
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com