
| A. | 将NaHCO3固体加入新制的氯水中,有无色气泡(H+) | |
| B. | 向FeCl2溶液中滴加新制氯水,再滴加KSCN溶液,发现呈红色(Cl2) | |
| C. | 将FeCl2溶液滴到氨水中生成的白色沉淀很快变色(O2) | |
| D. | 将FeCl3溶液滴到淀粉-KI试纸上,试纸变蓝(Cl-) |
分析 A.氯气与水反应,发生Cl2+H2O=H++Cl-+HClO,溶液呈酸性;
B.氯化亚铁被氯气氧化生成氯化铁;
C.氯化亚铁与氨水反应生成具有还原性的氢氧化亚铁;
D.氯化铁氧化电离子生成碘.
解答 解:A.氯水显酸性,能与碳酸氢钠反应生成CO2气体,故A不选;
B.氯化亚铁具有还原性,被氯气氧化生成氯化铁,再滴加KSCN溶液,溶液呈红色,故B不选;
C.氯化亚铁与氨水反应生成具有还原性的氢氧化亚铁,可被氧化氧化生成氢氧化铁,故C不选;
D.氯化铁氧化电离子生成碘,与氯离子无关,故D选.
故选D.
点评 本题考查较为综合,涉及氯水的成分及氯气的化学性质、次氯酸的化学性质以及氨水、氯化铁等知识,明确氯水的成分是解答本题的关键,并熟悉各微粒的性质来解答即可.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | O3在反应中被还原为O2 | |
| B. | 1mol O3在反应中得到2mol电子 | |
| C. | 该反应的还原产物为I2 | |
| D. | 反应中氧化产物与还原产物物质的量之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3比NaHCO3稳定得多 | |
| B. | NaHCO3比Na2CO3难溶于水 | |
| C. | 用物质的量相同的苏打和小苏打可得到相同质量的CO2 | |
| D. | 石灰水既能和Na2CO3反应,又能与NaHCO3反应,且反应原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | I1 | I2 | I3 | I4 |
| A | 2080 | 4000 | 6100 | 9400 |
| B | 500 | 4600 | 6900 | 9500 |
| C | 740 | 1500 | 7700 | 10500 |
| D | 580 | 1800 | 2700 | 11600 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
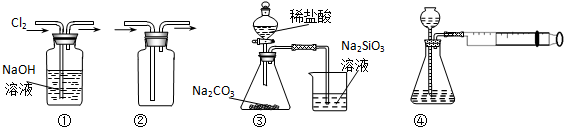
| A. | 装置①可用于除去Cl2中含有的少量HCl气体 | |
| B. | 装置④向左推动针筒活塞可检验该装置的气密性 | |
| C. | 装置③可证明非金属性Cl>C>Si | |
| D. | 按装置②所示的气流方向可用于收集H2、NH3等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |
| Z | W |
| A. | 元素X和元素W最高正价代数和一定为8 | |
| B. | 若元素X的原子序数为a,则Z的原子序数一定为a+9. | |
| C. | 常温下,若X的简单氢化物的水溶液能使红色石蕊试液变蓝,则元素Y的简单氢化物的沸点一定高于元素W的简单氢化物 | |
| D. | 原子半径的大小顺序为rW>rZ>rX>rY. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com