
实验室要配制1.84 mol·L-1的稀硫酸500mL,回答下列问题:
(1)需要98%密度为1.84 g·cm-3的浓硫酸 mL
(2)配制时,必须使用的仪器有 (填代号)
①烧杯 ②50 mL量筒 ③100 mL量筒 ④1000 mL容量瓶 ⑤500 mL容量瓶
⑥托盘天平(带砝码) ⑦玻璃棒 还缺少的仪器是 。
(3)配制时,该实验两次用到玻璃棒,其作用分别是 、 。
(4)下列操作的顺序是(用字母表示) 。
A. 冷却 B.量取 C.洗涤两次 D.定容 E.稀释 F.摇匀 G.转移
(5)下列操作中,容量瓶所不具备的功能有 (填序号)。
A. 配制一定体积准确浓度的标准溶液 B. 长期贮存溶液
C. 用来加热溶解固体溶质 D. 作为反应容器
(6)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
① 用量筒量取浓硫酸时,仰视读数
② 转移后,没有洗涤烧杯和玻璃棒
③ 定容时,俯视读数
④ 定容时,添加蒸馏水超过刻度线后,吸出多余的溶液
(1)50
(2)①②⑤⑦,胶头滴管
(3)搅拌、引流
(4)BEAGCGDF;
(5)BCD
(6)①偏高②偏低③偏高④偏低
解析试题分析:(1)浓硫酸的物质的量浓度为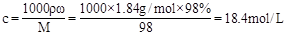 ,要配置1.84 mol·L-1的稀硫酸500mL,需要该浓度的浓硫酸为V=
,要配置1.84 mol·L-1的稀硫酸500mL,需要该浓度的浓硫酸为V=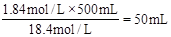 。
。
(2)配制时必须使用的仪器有烧杯、50 mL量筒、500 mL容量瓶、玻璃棒,除此之外还需要胶头滴管。
(3)配制时两次用到玻璃棒的作用不同,分别为搅拌和引流。
(4)配置一定物质的量浓度溶液的过程为:计算、量取、稀释、冷却转移、洗涤、定容、摇匀和装瓶贴签,所以正确的顺序为BEAGCGDF。
(5)容量瓶只是配制溶液的仪器,贮存溶液,溶解固体和作为反应容器都不是容量瓶的功能。所以选BCD。
(6)根据c=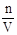 ,用量筒量取浓硫酸仰视读数,溶质的物质的量比正常值大,溶液的浓度偏高,转移后没有洗涤烧杯和玻璃棒,溶质的物质的量比正常值小,溶液的浓度偏低,定容时俯视读数,溶液的体积比正常值小,溶液的浓度偏高,定容时添加蒸馏水超出刻度线,溶液的体积比正常值大,溶液的浓度偏低。
,用量筒量取浓硫酸仰视读数,溶质的物质的量比正常值大,溶液的浓度偏高,转移后没有洗涤烧杯和玻璃棒,溶质的物质的量比正常值小,溶液的浓度偏低,定容时俯视读数,溶液的体积比正常值小,溶液的浓度偏高,定容时添加蒸馏水超出刻度线,溶液的体积比正常值大,溶液的浓度偏低。
考点:一定物质的量浓度溶液的配制
点评:本题比较基础,主要考查学生的基本实验操作。


科目:高中化学 来源:浙江省杭州市西湖高级中学2011届高三上学期开学考试化学试题 题型:022
实验室要配制1 mol/L的稀硫酸250 mL,回答下列问题:
(1)需要98%密度为1.84 g/cm3的浓硫酸________mL
(2)配制时,必须使用的仪器有________(填代号)
①烧杯
②100 mL量筒
③20 mL量筒
④1000 mL容量瓶
⑤250 mL容量瓶
⑥托盘天平(带砝码)
⑦玻璃棒 还缺少的仪器是________.
(3)配制时,该实验两次用到玻璃棒,其作用分别是________、________.
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
①没有洗涤烧杯和玻璃棒.________.
②如果加水超过了刻度线,取出水使液面恰好到刻度线.________.
③容量瓶没有干燥.________
查看答案和解析>>
科目:高中化学 来源:2012-2013学年重庆市重庆一中高一10月月考化学试卷(带解析) 题型:实验题
(14分)I.实验室用Na2CO3·10H2O晶体配制50 g质量分数为21.2%的Na2CO3溶液。回答下列问题:
(1)应用托盘天平称取Na2CO3·10H2O晶体 g。
(2)用托盘天平和小烧杯称出碳酸钠晶体的质量,天平平衡后的状态如下图。由图中可以看出,该同学在操作时犯了一个错误是 。实际称量的碳酸钠晶体质量为 g。
II. 实验室要配制2.5 mol/L 的稀硫酸溶液90 mL,回答下列问题:
(1)用量筒量取质量分数为98%,密度为1.84 g/cm3的浓硫酸 mL。
(2)配制时,必须使用的仪器除量筒、烧杯、玻璃棒外,还缺少的仪器是 。
(3)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是 。
| A.量取浓硫酸时,仰视读数 |
| B.洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中 |
| C.稀释硫酸时,有溶液溅到桌面上 |
| D.没有洗涤稀释硫酸的烧杯和玻璃棒 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省聊城市东昌府区高三9月模拟调研(四)化学试卷(解析版) 题型:实验题
实验室要配制1.84 mol·L-1的稀硫酸500mL,回答下列问题:
(1)需要98%密度为1.84 g·cm-3的浓硫酸 mL
(2)配制时,必须使用的仪器有 (填代号)
①烧杯 ②50 mL量筒 ③100 mL量筒 ④1000 mL容量瓶 ⑤500 mL容量瓶
⑥托盘天平(带砝码) ⑦玻璃棒 还缺少的仪器是 。
(3)配制时,该实验两次用到玻璃棒,其作用分别是 、 。
(4)下列操作的顺序是(用字母表示) 。
A. 冷却 B.量取 C.洗涤两次 D.定容 E.稀释 F.摇匀 G.转移
(5)下列操作中,容量瓶所不具备的功能有 (填序号)。
A. 配制一定体积准确浓度的标准溶液 B. 长期贮存溶液
C. 用来加热溶解固体溶质 D. 作为反应容器
(6)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
① 用量筒量取浓硫酸时,仰视读数
② 转移后,没有洗涤烧杯和玻璃棒
③ 定容时,俯视读数
④ 定容时,添加蒸馏水超过刻度线后,吸出多余的溶液
查看答案和解析>>
科目:高中化学 来源:2015届重庆市高一10月月考化学试卷(解析版) 题型:实验题
(14分)I.实验室用Na2CO3·10H2O晶体配制50 g 质量分数为21.2%的Na2CO3溶液。回答下列问题:
(1)应用托盘天平称取Na2CO3·10H2O晶体 g。
(2)用托盘天平和小烧杯称出碳酸钠晶体的质量,天平平衡后的状态如下图。由图中可以看出,该同学在操作时犯了一个错误是 。实际称量的碳酸钠晶体质量为 g。

II. 实验室要配制2.5 mol/L 的稀硫酸溶液90 mL,回答下列问题:
(1)用量筒量取质量分数为98%,密度为1.84 g/cm3的浓硫酸 mL。
(2)配制时,必须使用的仪器除量筒、烧杯、玻璃棒外,还缺少的仪器是 。
(3)配制溶液的过程中,其他操作都正确,下列操作会使所配溶液浓度偏高的是 。
A.量取浓硫酸时,仰视读数
B.洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
C.稀释硫酸时,有溶液溅到桌面上
D.没有洗涤稀释硫酸的烧杯和玻璃棒
E.定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
F.容量瓶不干燥
(4)从容量瓶中取该溶液40 mL,与5 mol/L的NaOH溶液 mL恰好完全反应,反应后溶液中的c(Na+)= (忽略溶液混合过程中的体积变化)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com