
| A、X=2 |
| B、平衡时混合气体密度增大 |
| C、平衡时B的浓度为1.5mol?L-1 |
| D、当A与B的正反应速率为3:1时该反应达到平衡 |
| 4mol |
| 4L |


科目:高中化学 来源: 题型:
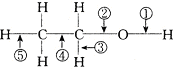 在乙醇的化学性质中,各反应的断键方式可概括如下
在乙醇的化学性质中,各反应的断键方式可概括如下查看答案和解析>>
科目:高中化学 来源: 题型:
| A、复合材料的使用可以使导弹经受超高温的变化 |
| B、复合材料的使用可以使导弹的质量减轻 |
| C、复合材料的使用可以使导弹承受超高温度的压力 |
| D、复合材料的使用可以使导弹承受温度的剧烈变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用惰性电极电解氯化镁溶液:2Cl-+2H+
| ||||
| B、用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+═I2+2H2O | ||||
C、碳酸钠的水解:
| ||||
D、硝酸银溶液中滴加过量氨水:Ag++NH3?H2O═AgOH↓+N
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热为2×(-57.3)kJ/mol | ||
B、CO(g)的燃烧热是-283.0 kJ/mol,则表示CO燃烧热的热化学方程式为CO(g)+
| ||
| C、需要加热才能发生的反应一定是吸热反应 | ||
| D、1 mol硫燃烧生成气态三氧化硫所放出的热量是硫磺的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
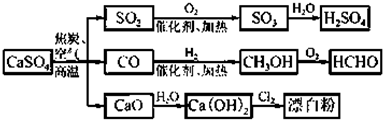
| A、CO、SO2、SO3均是酸性氧化物 |
| B、用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100% |
| C、工业上利用Cl2和澄清石灰水反应来制取漂白粉 |
| D、除去与水反应,图示转化反应均为氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com