
分析 含有银离子或氯离子的溶液抑制AgCl溶解,氯离子或银离子浓度越大其抑制AgCl溶解程度越大;根据c(Cl-)=$\frac{{K}_{sp}(AgCl)}{c(A{g}^{+})}$计算出溶液②中c(Cl-).
解答 解:含有银离子或氯离子的溶液抑制AgCl溶解,氯离子或银离子浓度越大其抑制AgCl溶解程度越大,氯化镁和硝酸银溶液抑制AgCl溶解,但硝酸银是可溶性盐,所以硝酸银溶液中银离子浓度最大,则Ag+浓度由大到小的顺序为:②①③;
溶液②中c(Cl-)=$\frac{{K}_{sp}(AgCl)}{c(A{g}^{+})}$=$\frac{1.8×1{0}^{-10}}{0.3}$mol/L=6×10-10 mol/L,
故答案为:②①③;6×10-10mol/L.
点评 本题考查了难溶物溶解平衡及其应用,题目难度中等,明确溶度积的概念及表达式为解答关键,注意掌握溶解平衡及其影响因素,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
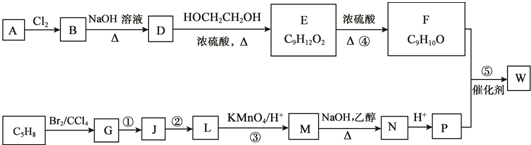
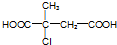 .
. ;D中含氧官能团的名称是羟基;④的反应类型是消去反应.
;D中含氧官能团的名称是羟基;④的反应类型是消去反应.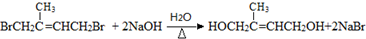 .
. .
.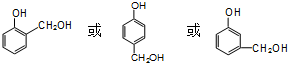 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
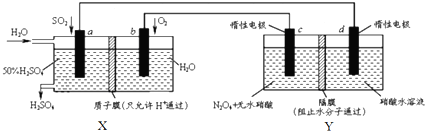
| A. | X是原电池,能够生产硫酸.Y是电解池,能够生产N2O5 | |
| B. | c电极的电极反应方程式为:N2O4+2HNO3-2e-=2N2O5+2H+ | |
| C. | 当电路中通过2mol e-,X、Y中各有1molH+从左边迁移到右边 | |
| D. | 为保证X中硫酸的质量分数不变,则加入的n(so2):n(H2O)=1:7.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:Y<X<W | |
| B. | 简单气态氢化物的热稳定性:Y<X | |
| C. | 化合物ZW、XY中化学键类型相同 | |
| D. | X、W的最高价氧化物的水化物均为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
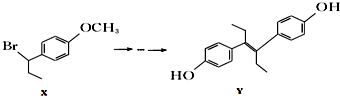
| A. | 化合物x中不含有手性碳原子 | |
| B. | 1mol化合物Y与浓溴水反应,最多消耗5mol Br2 | |
| C. | 在一定条件下化合物Y能发生加聚反应、缩聚反应 | |
| D. | 在氢氧化钠水溶液中加热,化合物X能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
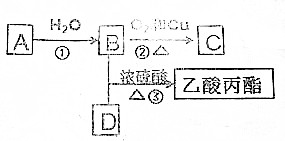
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子间都以单链相连的链烃是烷烃 | |
| B. | 所有糖类物质都有甜味 | |
| C. | 油与脂肪都属于甘油酯 | |
| D. | 葡萄糖与果糖互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol/L | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| c(S2O${\;}_{8}^{2-}$)/mol/L | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
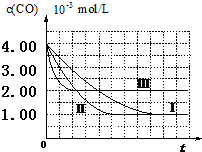 目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 6.50×10-3 | 120 | |||
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com