
【题目】I.下列七种有机物中:①CH4 ②CH2=CH2 ③![]() ④CH3COOH ⑤HOCH2CHO ⑥CH3CH2CH2CH3 ⑦葡萄糖 ⑧蛋白质 ⑨淀粉
④CH3COOH ⑤HOCH2CHO ⑥CH3CH2CH2CH3 ⑦葡萄糖 ⑧蛋白质 ⑨淀粉
(1)可与浓硝酸发生颜色反应的是______________(填序号,下同)。
(2)属于同系物的是__________
(3)互为同分异构体的是___________。.
(4)易发生银镜反应的是______________
II.在5L的密闭容器中充入1mol A 和2mol B,在一定条件下发生反应4A(g)+5B(g)![]() 4C(g)+6D(g),半分钟后,C的物质的量增加了0.30mol.
4C(g)+6D(g),半分钟后,C的物质的量增加了0.30mol.
(5)D的平均反应速率为 .
(6)A的转化率为
(7) 不能判断该反应已达平衡状态的是
A 单位时间内生成n mol A的同时生成2n mol D的状态
B 生成物浓度不再变化的状态 .
C 混合气体的平均相对分子质量不再改变的状态.
D 混合气体的压强不再改变的状态
E 容器中各组分的体积分数不随时间变化的状态
F 容器中A、B、C、D的物质的量的比一定是4:5:4:6的状态
【答案】I. (1)⑧;(2)①⑥;(3)④⑤;(4)⑤⑦;II.(5)0.18mol·L-1·min-1 ;(6)30%;(7)AF。
【解析】
试题分析:(1)能与硝酸发生颜色反应是蛋白质,即⑧;(2)同系物:组成和结构相似,相差若干个“CH2”的化合物,因此属于同系物的是①⑥;(3)同分异构体:分子式相同,结构不同的化合物,属于同分异构体是④⑤;(4)能发生银镜反应,说明含有醛基,⑤⑧中含有醛基;(5)根据化学反应速率的数学表达式,v(C)=0.3/(5×0. 5)mol/(L·min)=0.12 mol/(L·min),根据化学反应速率之比等于化学计量数之比,v(D)=6v(C)/4=0.18mol/(L·min);(6)生成C的物质的量为0.3mol,则消耗A的物质的量为0.3mol,A的转化率为0.3/1×100%=30%;(7)用不同物质的反应速率判断达到平衡状态,要求反应一正一逆,且反应速率之比等于系数之比,虽然反应方向是一正一逆,但比值不等于系数之比,不能作为达到平衡的标志,故正确;B、根据化学平衡的状态的定义,各组分的浓度不再改变,故错误;C、M=m/n,组分都是气体,m保持不变,反应前后气体系数之和不相等,即n改变,当M不再改变说明反应达到平衡,故正确;D、压强和气体物质的量成正比,反应前后气体系数之和不相等,则压强不变,说明反应达到平衡,故错误;E、根据化学平衡的定义,故错误;F、组分物质的量比值,不能说明达到平衡,故正确。


科目:高中化学 来源: 题型:
【题目】类比法是化学学习过程中一种重要方法,以下类比关系正确的是( )
A.工业上可以电解熔融的氯化镁或氯化铝制得相应的金属单质
B.Cl2、Br2、I2都具有强氧化性,都能将铁氧化成+3价的铁盐
C.二氧化碳和二氧化硫都是氧化物,两者都不能和氯化钙溶液反应
D.氧化铁和氧化亚铁都是碱性氧化物,和硝酸反应都只生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:2SO2(g)+O2(g) ![]() 2SO3(g)ΔH=-Q kJ·mol-1(Q>0)。下列说法正确的是
2SO3(g)ΔH=-Q kJ·mol-1(Q>0)。下列说法正确的是
A.相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量
B.2 mol SO2(g)和1 mol O2(g)在密闭容器中充分反应,放出热量小于Q kJ
C.增大压强或升高温度,该反应过程都能放出更多的热量
D.2 mol SO2(g)和1 mol O2(g)在密闭容器中充分反应,放出热量等于Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鲨鱼是世界上唯一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性.已知角鲨烯分子中含有30个碳原子及6个C=C且不含环状结构,则其分子式为( )
A.C30H60 B.C30H56 C.C30H52 D.C30H50
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见反应的化学方程式有A+B→X+Y+H2O或H2O+A+B→X+Y(未配平,反应条件略去),下列问题所涉及反应是上述两个方程式之一。请回答:
(1)常温下,若A为黄绿色气体,B为非金属氧化物,A、B均能使品红溶液褪色,A+B+H2O→X+Y,且相对分子质量X>Y,则该反应的化学方程式________,检验Y中阴离子的试剂是__________。
(2)若A为常见的金属单质,Y为气态单质,B溶液呈强酸性或强碱性时,A和B反应都能进行。写出A与B反应的离子方程式: ; 。
(3)若A为常见的非金属单质,它是构成有机物的基本元素之一,B的溶液为某浓酸,其中A、B的物质的量之比为1∶4,则该反应化学方程式为 。
(4)若A、B均为化合物,Y为白色沉淀(不含金属元素),B为引起温室效应的主要气体,写出A与B反应生成Y的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解结晶水合物CuCl·2H2O制备CuCl,并进行相关探究。

【实验探究】该小组用下图所示装置进行实验(夹持仪器略)。
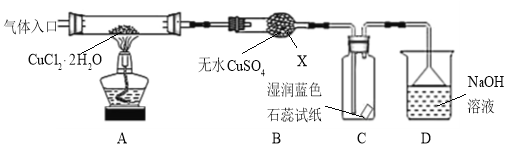
请回答下列问题:
(1)仪器X的名称是 。
(2)实验操作的先后顺序是![]()
![]() (填操作的编号)。
(填操作的编号)。
a.检查装置的气密性后加入药品
b.熄灭酒精灯,冷却
c.在“气体入口”处通入干燥HCl
d.点燃酒精灯,加热
e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是 。
(4)装置D中发生的氧化还原反应的离子方程式是 。
【探究反思】
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息分析:
①若杂质是CuCl2,则产生的原因是 。
②若杂质是CuO,则产生的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修2:化学与技术]
信息时代给人们的生活带来了极大的便利,但同时也产生了大量的电子垃圾。某化学兴趣小组将一批废弃的线路板简单处理后,得到了主要含Cu、Al及少量Fe、Au等金属的混合物,并设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:

部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

(1)过滤操作中用到的玻璃仪器有___________。
(2)Cu可溶于稀硫酸与H2O2的混合溶液,其离子方程式是____________。
(3)滤渣a的主要成分是_________________。
(4)步骤③中X的取值范围是____________________。
(5)为了测定硫酸铜晶体的纯度,该组甲同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI和淀粉指示剂,用0.1000 mol·L-1Na2S2O3标准溶液滴定至终点。共消耗14.00mLNa2S2O3标准溶液。上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①样品中硫酸铜晶体的质量分数为____________。
②该组乙同学提出通过直接测定样品中SO42-的量也可求得硫酸铜晶体的纯度,老师审核后予以否决,其原因是______________。
(6)请你设计一个由滤渣c得到Al2(SO4)3·18H2O的实验方案___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有a mol/L 的NaX和b mol/L的NaY两种盐溶液。下列说法正确的是
A.若a=b且c(X-)= c(Y-)+ c(HY),则HX为强酸
B.若a=b且pH(NaX)>pH(NaY),则c(X-)+ c(OH-)> c(Y-)+ c(OH-)
C.若a>b且c(X-)= c(Y-),则酸性HX>HY
D.若两溶液等体积混合,则c(Na+)=(a+b) mol/L(忽略混合过程中的体积变化)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com