
| A、①④ | B、①②④ |
| C、②③⑤ | D、②④⑤ |


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
| B、充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O |
| C、放电时每转移3mol电子,正极有1mol K2FeO4被还原 |
| D、放电时正极附近溶液的酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气态氢化物的稳定性:B<E |
| B、最高价氧化物对应的水化物碱性:C<D |
| C、简单离子半径:E<D |
| D、均含有A,B,C,E四种元素形成的两种化合物可以相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L H2和O2的混合气体中所含的分子数为NA |
| B、6.8g熔融的KHSO4中含有0.05NA个阳离子 |
| C、21.6 g X单质与Cl2完全反应,生成106.8 g XC13.,则X的相对原子质量为27g/mol |
| D、0.1molNa2O2晶体中含有0.1NA个阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
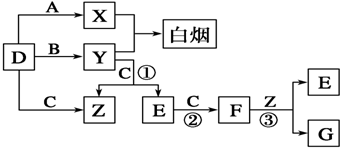
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4HCO3和盐酸的反应是放热反应 |
| B、NH4HCO3和盐酸的反应是吸热反应 |
| C、反应物的总能量高于生成物的总能量 |
| D、反应的热化学方程式为:NH4HCO3+HCl═NH4Cl+CO2↑+H2O△H=+Q kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验内容 | 实验目的 |
| A | 向某溶液中加入稀H2SO4,将产生的气体通入澄清石灰水 | 检验溶液中是否含有CO32- |
| B | 向沸水中滴加几滴FeCl3饱和溶液,继续加热至液体呈红褐色 | 制备Fe(OH)3胶体 |
| C | 相同温度下,测定浓度均为0.1mol?L-1的Na2CO3和CH3COONa溶液的pH | 比较CH3COO-和CO32-结合H+的能力强弱 |
| D | 将AlCl3溶液蒸干灼烧 | 制备Al2O3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com