
(5分)右图是实验室常用的制取气体的装置
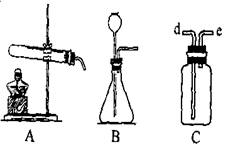
(1)采用B装置制取氧气时化学方程式:
(2)C装置用途很多,可用来洗气。如要除去O2中少量的CO2可用到此装置,此时瓶中盛 (填化学式)溶液,导管由 进 出(填d或e,下同) ;用排空气法收集氢气(瓶中为空气),导管由 进 出 。
⑴2H2O2=2H2O+O2↑(条件:MnO2)
⑵NaOH , d e, e d
【解析】
试题分析:B装置是典型的固液不加热制气体,在制备氧气的反应中,只有过氧化氢的催化分解,因此方程式为2H2O2=2H2O+O2↑(条件:MnO2)。(2)CO2是酸性氧化物,要想吸收CO2应该用NaOH。C装置长进短出可以洗气,所以是d进e出。排空气法收集氢气应该是向下排空气法,C装置短进长出为向下排空气法,所以是e进d出。
考点:化学实验基本仪器
点评:本题是一道非常热点也是非常基础的实验基本仪器使用题。A装置是典型的固固加热制备气体的装置,B装置是典型的固液不加热制备气体的装置,C装置则用途广泛,如果装入液体,则长进短出是洗气,短进长出是排水法集气,如果不装入液体,则长进短出是向上排空气法集气,短进长出是向下排空气法集气。


科目:高中化学 来源: 题型:阅读理解
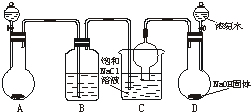 侯德榜先生是我国举世闻名的化工专家,他对制碱技术作出了重大贡献,他所发明的联合制碱法称作“侯氏制碱法”.右图是在实验室中模拟“侯氏制碱法”中制取碳酸氢钠一步的实验装置,实验步骤为:
侯德榜先生是我国举世闻名的化工专家,他对制碱技术作出了重大贡献,他所发明的联合制碱法称作“侯氏制碱法”.右图是在实验室中模拟“侯氏制碱法”中制取碳酸氢钠一步的实验装置,实验步骤为:查看答案和解析>>
科目:高中化学 来源: 题型:
(10分,每空2分)右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
(1)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.30 mol/L稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) 。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,轻轻摇动容量瓶
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30 mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶的玻璃塞盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
③在配制过程中,下列操作会使所配制的稀盐酸物质的量浓度偏高的是 。
A.用量筒量取浓盐酸时俯视观察凹液面
B.摇匀后,液面下降,补充水
C.定容时仰视刻度线
D.在配制前用相同浓度的稀盐酸润洗容量瓶
(2)现将200mL0.30mol/L的盐酸与50mL0.80mol/LCaCl2溶液混合(混合后体积变化忽略不计),所得溶液中Cl-的物质的量浓度是 mol/L。
(3)在标准状况下,将_____________L HCl气体溶于1000 mL水中(水的密度为1 g/cm3),所得溶质质量分数为36.5%的盐酸。(保留小数点后一位)
查看答案和解析>>
科目:高中化学 来源:2012-2013学年新疆布尔津县高中高一分班考试化学试卷(带解析) 题型:实验题
(5分)右图是实验室常用的制取气体的装置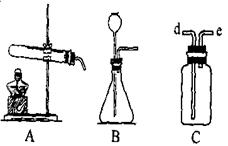
(1)采用B装置制取氧气时化学方程式:
(2)C装置用途很多,可用来洗气。如要除去O2中少量的CO2可用到此装置,此时瓶中盛 (填化学式)溶液,导管由 进 出(填d或e,下同);用排空气法收集氢气(瓶中为空气),导管由 进 出。
查看答案和解析>>
科目:高中化学 来源:2014届重庆市高一上学期期中考试化学试卷 题型:填空题
(10分,每空2分)右图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:

(1)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.30 mol/L稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) 。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,轻轻摇动容量瓶
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30 mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶的玻璃塞盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
③在配制过程中,下列操作会使所配制的稀盐酸物质的量浓度偏高的是 。
A.用量筒量取浓盐酸时俯视观察凹液面
B.摇匀后,液面下降,补充水
C.定容时仰视刻度线
D.在配制前用相同浓度的稀盐酸润洗容量瓶
(2)现将200mL0.30mol/L的盐酸与50mL0.80mol/LCaCl2溶液混合(混合后体积变化忽略不计),所得溶液中Cl-的物质的量浓度是 mol/L。
(3)在标准状况下,将_____________L HCl气体溶于1000 mL水中(水的密度为1 g/cm3),所得溶质质量分数为36.5%的盐酸。(保留小数点后一位)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com