
| 族 周期 | IA | 0 | ||||||
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
分析 由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是S,
(1)上述元素中只有N、S的最高价氧化物的水化物为强酸,Na的金属性最强,最高价氧化物的水化物碱性最强;
(2)电子层相同的离子,核电荷数越大半径越小;
(3)由①、④、⑤、三种元素H、O、Na形成的化合物是氢氧化钠;
(4)符合同一反应中两种单质对应元素既不同周期也不同主族的置换反应,如Mg置换C、Mg置换H;
(5)A、B、C含同一金属元素,X为强电解质,由图中连续反应可知,若A为铝盐,X为NaOH;若A为偏铝酸盐,X为强酸.
解答 解:由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是S,
(1)在上述元素的最高价氧化物对应的水化物中:属于强酸的是H2SO4、HNO3;碱性最强的是NaOH,
故答案为:H2SO4、HNO3;NaOH;
(2)电子层相同的离子,核电荷数越大半径越小,则离子半径为O2->Na+>Al3+,
故答案为:O2->Na+>Al3+;
(3)由①、④、⑤、三种元素H、O、Na形成的化合物是氢氧化钠,它是离子化合物,存在离子键和极性共价键,
故答案为:离子键、共价键;
(4)符合同一反应中两种单质对应元素既不同周期也不同主族的置换反应,如Mg置换C、Mg置换H,反应分别为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO、Mg+H2SO4=MgSO4+H2↑,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$C+2MgO、Mg+H2SO4=MgSO4+H2↑;
(5)A、B、C含同一金属元素,X为强电解质,由图中连续反应可知,若A为铝盐,X为NaOH;若A为偏铝酸盐,X为强酸(如H2SO4或HNO3)则B均为Al(OH)3,
对应的反应①的离子方程式为:Al3++3OH-=Al(OH)3↓或【Al(OH)4】-+H+=Al(OH)3↓+H2O,
故答案为:Al(OH)3;Al3++3OH-=Al(OH)3↓或【Al(OH)4】-+H+=Al(OH)3↓+H2O.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素化合物性质为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不.


科目:高中化学 来源: 题型:选择题
| A. | 双氧水使酸性KMnO4溶液的红色褪去:3H2O2+2MnO4-+6H+=2Mn2++4O2↑+6H2O | |
| B. | HClO4的电离方程式:HClO4=H++ClO4- | |
| C. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| D. | Fe2+被空气氧化:4Fe2++O2+2H2O=4Fe3++4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
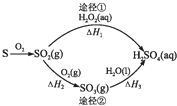
| A. | 已知S(l)+O2(g)═SO2(g)△H=-293.23kJ•mol-1,则S(s)+O2(g)═SO2(g)反应放出的热量小于293.23 kJ/mol | |
| B. | 含1 mol H2SO4的浓溶液与足量NaOH反应,放出的热量即为中和热 | |
| C. | 途径②中SO2和SO3均属于酸性氧化物 | |
| D. | 若△H1<△H2+△H3,则2H2O2(aq)═2H2O(l)+O2(g)为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色酚酞试液呈红色的溶液中:Na+、K+、SO42-、CO32- | |
| B. | 无色透明的溶液中:Cu2+、K+、SO42-、NO3- | |
| C. | 含有大量Ba(NO3)2的溶液中:Mg2+、NH4+、SO42-、Cl- | |
| D. | 紫色石蕊试液呈红色的溶液中:Ca2+、Cl-、Na+、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式为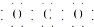 | B. | Cl-的结构示意图为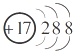 | ||
| C. | NaCl的电子式为Na+Cl- | D. | HCl的电子式为HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ⑨ | ④ | ⑤ | ⑩ | ⑥ | ⑦ | ⑧ |
 ;
; ,④元素与⑦元素形成化合物的电子式
,④元素与⑦元素形成化合物的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
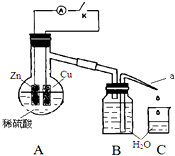 某同学分析Zn与稀H2SO4的反应.
某同学分析Zn与稀H2SO4的反应.| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH3:0.002 mol•L-1•s-1 | B. | H2O:0.0015 mol•L-1•s-1 | ||
| C. | NO:0.0015 mol•L-1•s-1 | D. | O2:0.00125 mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com