
分析 (1)据热化学方程式和盖斯定律计算写出热化学方程式;
(2)据图象写出水与甲烷反应的热化学方程式和氧气与甲烷反应的热化学方程式,再据热化学方程式计算.
解答 解:(1)①CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1=-36 kJ•mol-1
②CH4(g)+H2O(g)═CO(g)+3H2(g)△H2=+216 kJ•mol-1
依据盖斯定律①-②得到氢气与氧气反应生成水蒸气的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-252kJ•mol-1,
故答案为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-252kJ•mol-1;
(2)据图象分析,CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+216KJ/mol,CH4(g)+$\frac{1}{2}$O2(g)=CO(g)+2H2(g)△H=-36KJ/mol,
①若x=0.2,有0.8molH2O(g)和0.2molO2(g),0.2mol氧气反应放热0.2mol×36KJ/mol×2=14.4KJ,故答案为:-14.4;
②若x=0.5,当H2O(g)与O2(g)的物质的量之比为1,有0.5molH2O(g)和0.5molO2(g),0.5mol水蒸气反应吸热0.5mol×205.8KJ/mol=102.9KJ,0.mol氧气反应放热0.5mol×36KJ/mol×2=36KJ,总吸收能量为102.9KJ-36KJ=66.9KJ,故答案为:+66.9;
③反应①与②放出(或吸收)的总能量为0时,设水蒸气物质的量为amol,则氧气物质的量为(1-a)mol,有216KJ/mol×amol=36KJ/mol×2×(1-a)mol,解得:a=0.26mol,所以x=$\frac{1-0.35}{1}$=0.65,故答案为:0.65.
点评 本题考查了据能量变化图书写热化学方程式和据热化学方程式的计算,题目难度中等.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:选择题
| A. | 10g 46%的乙醇溶液所含氢原子数为1.2NA | |
| B. | 0.5 mol熔融的NaHSO4中含有的离子数目为1.5NA | |
| C. | 标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA | |
| D. | S2和S8的混合物共38.4g,其中所含硫原子数为1.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
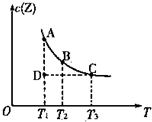 在容积不变的密闭容器中有反应:X(g)+Y(g)?Z(g),若Z(g)的物质的量浓度c(Z)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态).则下列说法不正确的是( )
在容积不变的密闭容器中有反应:X(g)+Y(g)?Z(g),若Z(g)的物质的量浓度c(Z)与温度T的关系如图所示(曲线上的任意一点都表示平衡状态).则下列说法不正确的是( )| A. | A点与B点相比,B点的c(X)大 | B. | A点与C点的化学反应速率:A<C | ||
| C. | 在反应进行到D点时,v正>v逆 | D. | 该反应的正反应是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | A | B | C | D |
| n(CO2)(mo1) | 1 | 2 | 3 | 4 |
| n(沉淀)(mo1) | 1 | 1 | 2 | 2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol•L-1 | B. | 1.6mol•L-1 | C. | 0.8mol•L-1 | D. | 0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16.8L | B. | 14L | C. | 19.6L | D. | 18.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该烃的名称是2-乙基-1-丁烯 | |
| B. | 该烃与H2加成得到的烷烃的名称是3-甲基戊烷 | |
| C. | 该烃可使溴水褪色,但不能与溴发生取代反应 | |
| D. | 该烃与HCl加成得两种卤代烃 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com