
【题目】如图是8种有机化合物的转换关系:
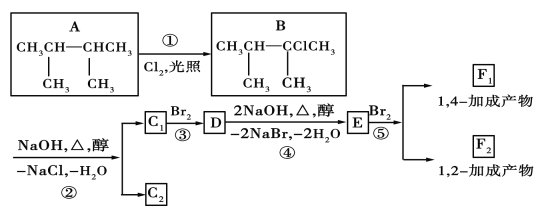
请回答下列问题:
(1)化合物E中含有的官能团的名称为___。
(2)上述框图中,①是___反应,③是___反应(填反应类型)。
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式:___。
(4)C1的结构简式是___;F1的结构简式是___。
【答案】碳碳双键 取代 加成 
![]()

【解析】
烷烃A与氯气发生取代反应生成卤代烃B,B发生消去反应生成C1、C2,C2与溴发生加成反应生成二溴代物D,D再发生消去反应生成E,E与溴可以发生1,2-加成或1,4-加成,故C2为![]() 或写成(CH3)2C=C(CH3)2,C1为
或写成(CH3)2C=C(CH3)2,C1为![]() ,则D为
,则D为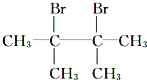 ,E为
,E为![]() ,F1为
,F1为 ,F2为
,F2为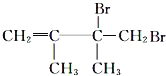 ,以此来解答。
,以此来解答。
(1)化合物E为![]() ,含有的官能团是碳碳双键;
,含有的官能团是碳碳双键;
(2)上述反应中,反应①中A中H原子被Cl原子取代生成B,属于取代反应,反应③是碳碳双键与溴发生加成反应,属于加成反应;
(3)由D生成E是卤代烃发生消去反应,该反应的化学方程式为 ;
;
(4)由上述分析可知,C1的结构简式是![]() ,F1的结构简式是
,F1的结构简式是 。
。


科目:高中化学 来源: 题型:
【题目】氧化锌是一种无毒的无机化合物,可用于生产婴儿爽身粉。锌焙砂主要含ZnO、ZnFe2O4,还含有少量Al2O3、FeO、Fe2O3、CuO、SiO2等氧化物。如图是工业上利用锌焙砂制取氧化锌的流程图。
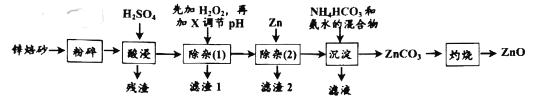
已知:几种常见金属离子形成氢氧化物沉淀时的pH值如下表:
氢氧化物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Zn(OH)2 |
开始沉淀pH | 7.0 | 2.7 | 3.7 | 4.2 | 6.4 |
完全沉淀pH | 9.2 | 3.2 | 5.2 | 6.7 | 8.0 |
回答下列问题:
(1)ZnFe2O4中铁的化合价是__,H2O2的电子式为___。
(2)“酸浸”时ZnFe2O4会生成两种盐,该反应的化学方程式为__。
(3)“除杂(1)”是为了除去浸出液中的Fe3+、Fe2+、Al3+,加入H2O2溶液的目的是(用离子方程式表示)__,为了加快反应速率,可适当加热。加入的H2O2溶液比预计的要多了许多,原因是:__;需要调节的pH的范围是__,所加的试剂X是__(填化学式)
(4)“沉淀”时,需要控制温度在40℃,目的是:__。
(5)“滤液”中溶质的主要成份是__(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1915年诺贝尔物理学奖授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献.
(1)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
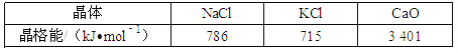
4种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是__.
(2)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下,其中配位键和氢键均采用虚线表示.
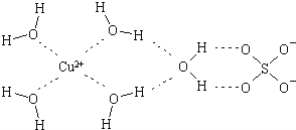
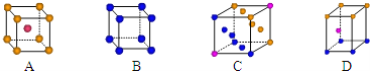
①写出基态Cu原子的核外电子排布式__;金属铜采用下列__(填字母代号)堆积方式.
②写出胆矾晶体中水合铜离子的结构简式(必须将配位键表示出来)__.
③水分子间存在氢键,请你列举两点事实说明氢键对水的性质的影响__.
④SO42﹣的空间构型是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度相同,向甲、乙两体积相同的密闭容器中,各通入2mol SO2和1 mol O2发生反应;
2SO2(g)+O2(g) ![]() 2SO3(g)达到平衡时,甲容器中SO2的转化率大于乙容器中SO2的转化率。下列判断正确的是 ( )
2SO3(g)达到平衡时,甲容器中SO2的转化率大于乙容器中SO2的转化率。下列判断正确的是 ( )
A.甲保持压强不变,乙保持体积不变
B.甲保持体积不变,乙保持压强不变
C.混合气体密度甲小于乙
D.混合气体的平均相对分子质量甲小于乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验与对应的图象不符合的是( )
A.①向一定体积的氢氧化钠溶液中逐滴加入稀盐酸溶液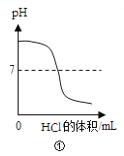
B.②将镁片和铁片(均足量)分别和等质量、等溶质质量分数的稀硫酸混合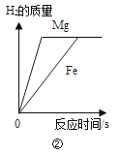
C.③是对于达到平衡状态的N2(g)+3H2(g)![]() 2NH3(g)反应,在t1时缩小容器体积
2NH3(g)反应,在t1时缩小容器体积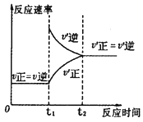
D.④是将pH=2的盐酸和醋酸分别加水稀释
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含25%BeO、71%CuS、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如图:
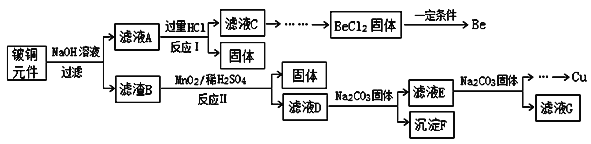
已知:I、铍、铝元素化学性质相似;
Ⅱ、常温下部分难溶物的溶度积常数如表:
难溶物 | Cu(OH)2 | Fe(OH)3 | Mn(OH)2 |
溶度积常数(Ksp) | 2.2×10-20 | 4.0×10-38 | 2.1×10-13 |
(1)滤液A的主要成分除NaOH、Na2BeO2外,还有___________(填化学式),写出反应I中Na2BeO2与过量盐酸反应的离子方程式:________。
(2)滤液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,最合理的实验步骤顺序为_______(填字母)
a.加入过量的氨水 b.通入过量的CO2 c.加入过量的NaOH d.加入适量的HCl e.洗涤 f.过滤
(3)MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应Ⅱ中CuS发生反应的化学方程式:___________。若用浓HNO3溶解金属硫化物,缺点是_______(任写一条)。
(4)滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=8.0×10-3mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入Na2CO3溶液调节pH可将其转变成氢氧化物依次分离,首先沉淀的是_______(填离子符号);为使铜离子开始沉淀,常温下应调节溶液的pH大于______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述不正确的是( )
A.相同质量的CO和N2,所含原子个数相同
B.pH=1的H3PO4溶液中,含有0.1NA个H+
C.标准状况下,11.2L甲烷和乙烯混合物中含极性键数目为2NA
D.足量锌与一定量浓H2SO4反应,生成1 mol气体时转移的电子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某溶液中由水电离产生的OH-的物质的量浓度为1×10-12mol/L,此溶液可能是( )
A.pH=12的KCN溶液B.pH=12的NaOH溶液C.0.01mol/LH2SO4D.0.02mol/LHCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】荣获2019年诺贝尔化学奖的吉野彰是最早开发具有商业价值的锂离子电池的日本科学家,他设计的可充电电池的工作原理示意图如图所示。该可充电电池的放电反应为LixCn+Li(1-x)CoO2=LiCoO2+nC。NA表示阿伏伽德罗常数的值。下列说法错误的是( )

A.该电池用于电动汽车可有效减少光化学烟雾污染
B.充电时,正极反应为LiCoO2-xe-=Li(1-x)CoO2+xLi+
C.放电时,Li+由A极移向B极
D.若初始两电极质量相等,当转移2NA个电子时,两电极质量差为14g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com