
| A. | CO32-+H2O?HCO3-+OH-:用热的纯碱溶液清洗油污 | |
| B. | A13++3H2O?AI(OH)3(胶体)+3H+:明矾净水 | |
| C. | SnCl2+H2O?Sn( OH)Cl↓+HCl配制氯化亚锡溶液时加入氢氧化钠溶液 | |
| D. | TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+3H+:制备TiO2纳米粉 |
分析 A.加热促进盐类水解;
B.明矾中的Al3+水解生成Al(OH)3胶体,能吸附水中的悬浮颗粒;
C.SnCl2水解显酸性,要加入HCl抑制其水解;
D.TiCl4能水解生成钛的氧化物.
解答 解:A.加热促进盐类水解,故加热纯碱溶液其碱性增强,去污能力增强,故A正确;
B.明矾中的Al3+水解生成Al(OH)3胶体,能吸附水中的悬浮颗粒,故明矾能净水,离子方程式为Al3++3H2O?Al(OH)3+3H+,故B正确;
C.4HClSnCl2水解显酸性,所以在配制氯化亚锡溶液时要加入HCl抑制其水解,不能加入NaOH,故C错误;
D.TiCl4能水解生成钛的氧化物,其水解方程式为:TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4HCl,故D错误;
故选CD.
点评 本题考查了盐类水解原理的应用,要注意影响水解的因素和反应产物的理解应用,题目较简单,试题培养了学生的分析能力及灵活应用能力.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2中有少量HCl气体(氢氧化钠溶液) | B. | CO中混有CO2(石灰水、浓硫酸) | ||
| C. | CO2中有少量CO(灼热氧化铜) | D. | Cl2中混有HCl(饱和食盐水、浓硫酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时,将完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| D. | 达到化学平衡时,正反应速率和逆反应速率都为零 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
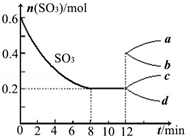 在一个2L的密闭容器中投入反应物,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中投入反应物,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol O的质量是16g•mol-1 | B. | 1mol CO2的质量是44 g•mol-1 | ||
| C. | 氢的摩尔质量是2 g•mol-1 | D. | Na+的摩尔质量是23 g•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定条件下水由气态变为液态 | |
| B. | 高温高压条件下使石墨转化为金刚石 | |
| C. | 有序排列的火柴散落 | |
| D. | CO点燃时生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCI+NaOH═NaCl+H2O | |
| B. | Zn+2HCl═ZnCl2+H2↑ | |
| C. | HCl+AgNO3═AgCl↓+HNO3 | |
| D. | MnO2+4HCI (浓) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+C12↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com