
配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏低的原因是
A.未洗涤烧杯和玻璃棒
B.转移溶液前溶液未冷却至室温
C.容量瓶未干燥
D.定容时俯视液面
科目:高中化学 来源:2015届江苏省、常州一中、沭阳中学高三联合调研化学试卷(解析版) 题型:选择题
一定条件下存在反应:2SO2(g) + O2(g) 2SO3(g),ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是
2SO3(g),ΔH<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,按如下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是

A.容器I、Ⅲ中平衡常数相同
B.容器II、Ⅲ中正反应速率相同
C.容器Ⅱ、Ⅲ中的反应达平衡时,SO3的体积分数:II>III
D.容器I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三质量调研化学试卷(解析版) 题型:实验题
(16分)粗食盐中除含有泥沙等不溶性杂质外,还含有钙离子、镁离子、硫酸根离子等可溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。通常经过以下步骤:①加入稍过量的BaCl2 溶液;②加入稍过量的NaOH溶液;③加入稍过量的Na2CO3溶液;④过滤;⑤滴入稀盐酸至无气泡产生;⑥蒸发结晶。
回答下列问题。
(1)步骤①中的BaCl2 溶液还可以换成__________(填字母)。
A.Ba(NO3)2溶液 B.Ba(OH)2溶液 C.A和B均可以
(2)步骤③中所发生反应的离子方程式为__________________________、________________________。
(3)步骤⑥需使用玻璃棒,其目的是________________________________________________________。
(4)步骤①、步骤②、步骤③的顺序还可以是______________________或________________________。
(5)用上述过程中获得的精盐配制240mL 0.8mol·L-1 NaCl溶液,步骤如下:计算→称量→溶解→转移→洗涤→定容→摇匀。
a.需要的NaCl固体质量为_________g;
b.定容时,当液面离刻度线1~2cm时应改用_________(填仪器名称)加水。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期第一次阶段性检测化学试卷(解析版) 题型:实验题
(15分)不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2。为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101 kPa,温度为0 ℃)。
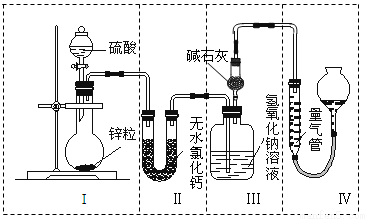
(1)若在烧瓶中放入0.65 g锌粒,与c mol·L-1的H2SO4反应,为保证实验结论的可靠,量气管的适宜规格是 。
A.200 mL B.300 mL C.400 mL
(2)若0.65g锌粒完全溶解,装置Ⅲ 增重0.64 g,则圆底烧瓶中发生反应的化学方程式为 ;
(3)若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g,量气管中收集到V mL气体,则有:a g÷65 g·mol-1×2=b g÷64 g·mol-1×2+V mL÷22400 mL·mol-1×2,该等式依据的原理是 ;
(4)若在烧瓶中投入10g锌,加入一定量的18 mol·L-1浓硫酸10 mL,充分反应后锌有剩余,测得装置Ⅲ 增重3.2 g,则整个实验过程产生的气体中,m(SO2)/m(H2)= ;若撤走装置Ⅱ中盛有无水氯化钙的U形管,m(SO2) / m(H2)的数值将 (填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期第一次阶段性检测化学试卷(解析版) 题型:选择题
在含有FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的NaOH溶液,在空气中充分搅拌反应后再加入过量的稀盐酸,溶液中离子数目减少的是
A.Na+ B.Fe3+ C.Al3+ D.Fe2+
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期第一次阶段性检测化学试卷(解析版) 题型:选择题
能证明SO2具有漂白性的是
A.品红溶液中通入SO2气体,溶液红色消失
B.溴水中通入SO2气体后,溶液褪色
C.滴入酚酞的NaOH溶液中通入SO2气体,红色消失
D.酸性KMnO4溶液中通入SO2气体后,溶液褪色
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期期中考试化学试卷(解析版) 题型:填空题
(14分)铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料。
(1)铝元素在元素周期表中的位置是____ 。
(2)铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。
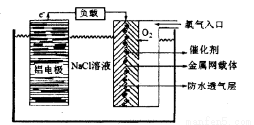
①该电池的总反应化学方程式为____ ;
②电池中NaCI的作用是 。
③以铝一空气电池为电源电解KI溶液制取KIO3(石墨为电极材料)时,电解过程中阳极的电极反应式为 。
④某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCI溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为 。(3)氯化铝广泛用于有机合成和石油工业的催化剂,聚氯化铝也被用于城市污水处理。
①氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则其结构式为 。
②将铝土矿粉与碳粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期期中考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.0.1 mloI·L-1H2SO4溶液:K+、Ba2+、NO3-、Cl-
B.0.1 mol·L-1NaOH溶液:K+、Na+、SO42-、HCO3-
C.0.l mol·L-lNaClO溶液:Fe2+、K+、I一、Cl-
D.c(OH-)/c(H+)=lxl014的溶液:Ba2+、Na+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源:2015届江苏省中学高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列有关物质的性质与应用相对应的是
A.二氧化锰具有强氧化性,可用作H2O2分解的氧化剂
B.K2FeO4具有还原性,可用于自来水的杀菌消毒
C.浓硝酸在常温下能使铝钝化,可用铝槽车运输浓硝酸
D.SO2具有漂白性,能使紫色KMnO4溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com