
【题目】(1)在恒温恒压密闭容器中充入1mol N2和3 mol H2在tl时刻达到平衡状态后,继续充入2 mol NH3,在t2时刻达到平衡状态。画出v(正)和v(逆)随时间t的变化关系__________________
(2)恒温恒容时,下列不能说明合成氨反应达到平衡状态的是__________________
a.容器内N2、H2、NH3的浓度之比为1 : 3 : 2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
e.单位时间内断裂6mol N-H键的同时,有3mol H-H形成
(3)将上述制得的的氨气溶于水配成溶液,25℃时,将amol/L的氨水与bmol/L盐酸等体积混合,反应后溶液恰好显中性,用a、b表示NH3·H2O的电离平衡常数Kb__________________(写出详细计算过程)
【答案】  abde b×10-7/(a-b)
abde b×10-7/(a-b)
【解析】试题分析:本题考查恒温恒压下的等效平衡规律,化学平衡的标志,电离平衡常数的计算。
(1)tl时刻达到平衡状态后,继续充入2 mol NH3,在恒温恒压容器中,逆反应速率突然变大,正反应速率突然变小,2molNH3采用一边倒极限换算后为1molN2和3molH2,在恒温恒压下达到的平衡与原平衡互为等效平衡,t2达到平衡时υ(正)和υ(逆)与原平衡相等,图像为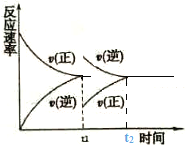 。
。
(2)合成氨的反应为N2+3H2![]() 2NH3。a项,达到平衡时各组分的浓度不再发生变化,但不一定等于化学计量数之比,容器内N2、H2、NH3的浓度之比为1 : 3 : 2时各物质的浓度不一定保持不变,不一定是平衡状态;b项,υ(N2)(正)=3υ(H2)(逆),用N2表示的正反应速率与用H2表示的逆反应速率之比为3:1,不等于化学计量数之比,没有达到平衡状态;c项,恒温恒容时气体的压强与气体物质的量成正比,该反应的正反应为气体分子数减小的反应,建立平衡过程中气体物质的量减小,容器内压强减小,达到平衡时气体物质的量不变,容器内压强不变,容器内压强保持不变能作为平衡的标志;d项,混合气体的密度=
2NH3。a项,达到平衡时各组分的浓度不再发生变化,但不一定等于化学计量数之比,容器内N2、H2、NH3的浓度之比为1 : 3 : 2时各物质的浓度不一定保持不变,不一定是平衡状态;b项,υ(N2)(正)=3υ(H2)(逆),用N2表示的正反应速率与用H2表示的逆反应速率之比为3:1,不等于化学计量数之比,没有达到平衡状态;c项,恒温恒容时气体的压强与气体物质的量成正比,该反应的正反应为气体分子数减小的反应,建立平衡过程中气体物质的量减小,容器内压强减小,达到平衡时气体物质的量不变,容器内压强不变,容器内压强保持不变能作为平衡的标志;d项,混合气体的密度=![]() ,该反应中所有物质都是气体,气体总质量始终不变,恒容容器体积始终不变,混合气体的密度始终不变,混合气体的密度保持不变不能作为平衡的标志;e项,单位时间内断裂6mol N-H键的同时一定有3molH-H形成,只描述了逆反应,不能作为平衡的标志;答案选abde。
,该反应中所有物质都是气体,气体总质量始终不变,恒容容器体积始终不变,混合气体的密度始终不变,混合气体的密度保持不变不能作为平衡的标志;e项,单位时间内断裂6mol N-H键的同时一定有3molH-H形成,只描述了逆反应,不能作为平衡的标志;答案选abde。
(3)25℃时,氨水与盐酸混合后溶液呈中性,c(H+)=c(OH-)=1![]() 10-7mol/L;溶液中存在电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-),则c(NH4+)=c(Cl-)=
10-7mol/L;溶液中存在电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-),则c(NH4+)=c(Cl-)=![]() mol/L;根据N原子守恒,溶液中c(NH3·H2O)=
mol/L;根据N原子守恒,溶液中c(NH3·H2O)=![]() mol/L-
mol/L-![]() mol/L=(
mol/L=(![]() )mol/L,NH3·H2O的电离平衡常数Kb=
)mol/L,NH3·H2O的电离平衡常数Kb=![]() =
=![]() 1
1![]() 10-7
10-7![]() (
(![]() )= b×10-7/(a-b)。
)= b×10-7/(a-b)。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】. A、B、C、D四种短周期元素的原子半径依次减小,A 与C的核电荷数之比为3:4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是( )
A. X、Y、Z的稳定性逐渐减弱
B. A、B、C、D只能形成5种单质
C. X、Y、Z三种化合物的熔沸点逐渐降低
D. 自然界存在多种由A、B、C、D四种元素组成的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在“绿色化学”工艺中,理想状态是反应物中的原子全能转化目标产物,即原子利用率为100%.在下列反应类型中,不能体现这一原子最经济性原则的是( )
A. 化合反应 B. 消去反应 C. 加成反应 D. 加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氮及其化合物的说法错误的是( )
A. N2化学性质稳定,是因为分子内氮氮键很强
B. NO、NO2均为大气污染气体,在大气中可稳定存在
C. 可用浓盐酸检测输送NH3的管道是否发生泄漏
D. HNO3具有强氧化性,可溶解铜、银等不活泼金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】aLAl2(SO4)3溶液中含有Al3+为b mol,则该溶液里SO42-的物质的量浓度为
A. 3b/2aB. 2b/3aC. 2b/aD. 3b/a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在NaCl、MgCl2、MgSO4形成的混合溶液中,n(Na+)=0.2mol,n(Mg2+)=0.35mol,n(Cl-)=0.7mol,则n(SO42-)为
A. 0.15mol B. 0.10mol C. 0.25mol D. 0.20mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016宜春校级模拟】在一定温度下,一定体积的密闭容器中有如下平衡:H2(g)+I2(g)2HI(g).已知H2和I2的起始浓度均为0.10molL﹣1时,达平衡时HI的浓度为0.16molL﹣1.若H2和I2的起始浓度均变为0.20molL﹣1,则平衡时H2的浓度(molL﹣1)是( )
A.0.16 B.0.08 C.0.04 D.0.02
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com