
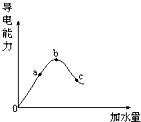
 (1)在一定温度下,纯的无水醋酸(又叫冰醋酸)是无色的液体.加水稀释的过程中,溶液的导电能力如图所示.回答:
(1)在一定温度下,纯的无水醋酸(又叫冰醋酸)是无色的液体.加水稀释的过程中,溶液的导电能力如图所示.回答:

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
| A、反应开始时,正反应速率最大,逆反应速率为零 |
| B、随着反应进行,正反应速率逐渐减小,最后为零 |
| C、随着反应进行,逆反应速率逐渐增大,最后不变 |
| D、随着反应的进行,正反应速率逐渐减小,最后不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、生物质能源是可再生能源,缺点是严重污染环境 |
| B、“春蚕到死丝方尽,蜡烛成灰泪始干”其中的“丝”和“泪”化学成分都是蛋白质 |
| C、对“地沟油”进行分馏可以得到汽油 |
| D、可溶性铜盐有毒,但在生命体中,铜是一种不可缺少的微量元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体的平均摩尔质量不变 |
| B、当容器中气体压强不变 |
| C、生成2mol Z的同时生成1mol X |
| D、混合气体的密度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学反应N2+3H2?2NH3的能量变化如图所示:
化学反应N2+3H2?2NH3的能量变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.如图是一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol/L的CuSO4溶液.请回答下列问题:
与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池.如图是一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol/L的CuSO4溶液.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
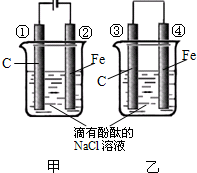 化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置.
化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com