
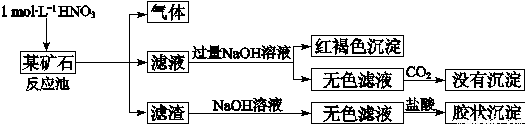
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。
(1)Si在周期表中的位置是 。
(2)下列说法正确的是 。
a.酸性:H2CO3>H2SiO3
b.原子半径:O<C<Si<Al
c.稳定性:H2O>CH4>SiH4
d.离子半径:O2-<Al3+
(3)该矿石的组成是 ,滤渣和NaOH溶液反应的离子方程式是 。
(4)该矿石和1 mol L-1HNO3反应的离子方程式 。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,目的是 ;若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol L-1 HNO3的体积为 L。
(1)第三周期、Ⅳ族 (2)abc
(3)FeCO3和SiO2 SiO2+2OH‾=SiO32‾+H2O
(4)3FeCO3+10H++NO3‾=3Fe3++3CO2↑+NO↑+5H2O
(5)NO循环使用能减少环境污染,NO跟H2O、O2反应后又得到硝酸,提高原料利用率;3×104。
【解析】
试题分析:(1)Si为14号元素,位于周期表第三周期、Ⅳ族 。
(2)碳元素的非金属性强于硅元素,则碳酸的酸性强于硅酸,a正确;根据原子半径变化规律可知,原子半径:O<C<Si<Al,b正确;非金属性越强,氢化物的稳定性越强,c正确;核外电子排布相同的微粒,微粒半径随原子序数的增大而减小,离子半径应该是O2->Al3+,则d不正确,故答案为abc。
(3)根据流程图,加入HNO3产生气体,加过量NaOH溶液产生红褐色沉淀,说明矿石含FeCO3,;无色滤液通入CO2,没有沉淀生成,说明矿石不含Al2O3,;滤渣加入NaOH溶液得到无色滤液,加盐酸生成胶状沉淀,说明矿石含SiO2,所以该矿石的组成是:FeCO3和SiO2;SiO2为酸性氧化物,与NaOH溶液反应的离子方程式为:SiO2+2OH‾=SiO32‾+H2O。
(4)矿石中的碳酸亚铁被硝酸氧化,所以反应的离子方程式是3FeCO3+10H++NO3- =3Fe3++3CO2↑+NO↑+5H2O。
(5)由于NO是有毒气体,不能随意排放,所以这样做的目的是NO循环使用能减少环境污染,且NO跟H2O、O2反应后又得到硝酸,提高原料利用率。根据以上分析可知,该矿石中含有碳酸亚铁和二氧化硅,其中碳酸亚铁的质量是2.36×103 kg-1.2×103 kg=1.16×103kg,物质的量是10000mol,则根据(4)中的方程式可知,消耗硝酸的物质的量是 ,所以理论上至少需要1 mol L-1 HNO3的体积为3.33×104
L。
,所以理论上至少需要1 mol L-1 HNO3的体积为3.33×104
L。
考点:本题考查流程图的分析、元素周期律的应用、物质的检验、氧化还原反应方程式的书写、尾气处理和原料的使用以及有关计算。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。
(1)Si在周期表中的位置是 。
(2)下列说法正确的是 。
a.酸性:H2CO3>H2SiO3
b.结合质子的能力:CO32->AlO2->HCO3-
c.稳定性:H2O>CH4>SiH4
d.离子半径:O2-<Al3+
(3)该矿石的组成是 ,滤渣和NaOH溶液反应的离子方程式是 。
(4)该矿石和1 mol L-1HNO3反应的离子方程式 。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,目的是 ;若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol L-1 HNO3的体积为 L。
查看答案和解析>>
科目:高中化学 来源:2014届四川成都棠湖中学外语实验学校高二5月月考化学卷(解析版) 题型:填空题
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。(已知:碳酸不能溶解Al(OH)3沉淀)
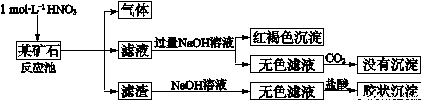
(1)用滤渣制备粗硅的化学反应方程式为
(2)下列说法正确的是
a.酸性:H2CO3>H2SiO3 b.结合质子的能力:CO> AlO2->HCO3-
c.稳定性:H2O>CH4>SiH4 d.离子半径:O2-<Al3+
(3)滤渣和NaOH溶液反应的离子方程式是
通过 现象说明此矿山中不含Al2O3
(4)该矿石和稀HNO3发生氧化还原反应的离子方程式为
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,主要两个目的是 , ;
若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg ,理论上至少需要1 mol L-1 HNO3的体积为 L。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省高三下学期二调考试理综试卷(解析版) 题型:填空题
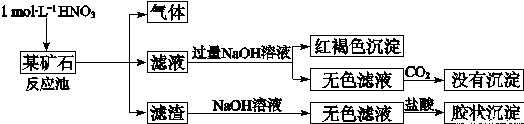
欲探究某矿石可能是由FeCO3、SiO2、Al2O3中的一种或几种组成,探究过程如下图所示。已知:碳酸不能溶解Al(OH)3沉淀。
(1)Si在周期表中的位置是 。
(2)下列说法正确的是 。
a.酸性:H2CO3>H2SiO3
b.结合质子的能力:CO32->AlO2->HCO3-
c.稳定性:H2O>CH4>SiH4
d.离子半径:O2-<Al3+
(3)该矿石的组成是 ,滤渣和NaOH溶液反应的离子方程式是 。
(4)该矿石和1 mol L-1HNO3反应的离子方程式 。
(5)工业上依据上述实验原理处理该矿石,将反应池逸出的气体与一定量的O2混合循环通入反应池中,目的是 ;若处理该矿石2.36×103 kg,得到滤渣1.2×103 kg,理论上至少需要1 mol L-1 HNO3的体积为 L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com