
| A. | 直径为20nm的纳米碳酸钙属于胶体 | |
| B. | 海水中提取镁的各步均为氧化还原反应 | |
| C. | 可溶性铁盐和铝盐可用作净水剂 | |
| D. | 光导纤维是一种新型硅酸盐材料 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
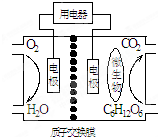
| A. | 该电池能够在高温下工作 | |
| B. | 电池的负极反应为:C6H12O6+6H2O-24e-=6CO2↑+24H+ | |
| C. | 放电过程中,H+从正极区向负极区迁移 | |
| D. | 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下气体$\frac{2.42}{6}$L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/s | 0 | 5 | 10 | 15 |
| c(NO2)mol/L | 4.00 | 2.52 | 2.00 | c3 |
| c(O2)mol/L | 1.00 | c1 | c2 | 0.50 |
| A. | 5s内O2的反应速率为0.074mol/L•s) | |
| B. | T1℃时平衡常数为0.125,平衡时NO2和O2的转化率均为50% | |
| C. | T1℃时平衡常数为K1,T2℃时平衡常数为K2,若T1>T2,则K1<K2 | |
| D. | 其它条件不变,将容器的体积的压缩到原来的一半,则重新达到平衡时c(N2O3)<2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用四氯化碳可以萃取乙酸水溶液中的乙酸 | |
| B. | 丁烷有两种同分异构体 | |
| C. | 乙烯可以与氢气发生加成反应,也可发生自身加聚反应生成聚乙烯 | |
| D. | 纤维素、淀粉和蛋白质都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
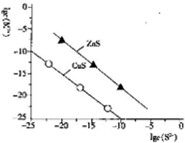
| A. | Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+) | |
| B. | 25℃时K甲(CuS)均为1×10-28 | |
| C. | 向l00mLZn2+、Cu2+均为10-5mol•L-1 的混合溶液中逐滴加入10-4mol•L-1 Na2S溶液,Zn2+先沉淀 | |
| D. | 向Cu2+浓度为10-5mol•L-1工业废水中加入ZnS粉末,会有CuS沉淀析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
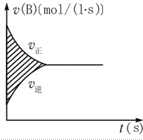
| A. | A浓度的减小量 | B. | B浓度的减小量 | ||
| C. | C物质的量的增加量 | D. | B物质的量的减少量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中还可能大量存在:H+、NH4+、SO42-、NO3- | |
| B. | AlCl3溶液与过量的氨水反应的离子方程式为:Al3++4NH3•H2O═4NH4++AlO2-+2H2O | |
| C. | 若NA为阿伏伽德罗常数的值,则1L0.1mol•L-1的AlCl3溶液中Al3+的数目为0.1NA | |
| D. | 工业上可用电解熔融的AlCl3来制取金属Al |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1mol CO2、3mol H2 | a mol CO2、3a mol H2、 b mol CH3OH(g)、b mol H2O(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com