
| A. | 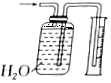 | B. | 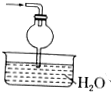 | ||
| C. | 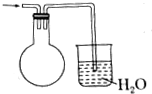 | D. | 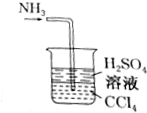 |
分析 A.氨气极易溶于水,装置中广口瓶中水会发生倒吸;
B.连接干燥管的上部面积较大,当氨气溶于水水倒吸后在球形部位会靠自身重量回落,不引起倒吸;
C.烧瓶中导气管略露出胶塞,引起倒吸后的水进入烧瓶,不会引发倒吸到上一发生装置;
D.导气管先插入四氯化碳,氨气不溶于四氯化碳,上升遇到硫酸溶液被吸收;
解答 解:A.氨气极易溶于水,导气管在水面上吸收,氨气通入后装置中广口瓶中压强减小水会发生倒吸,不能防止倒吸,故A符合;
B.当氨气通过装置后溶于水,水会发生倒吸,连接干燥管的上部面积较大,倒吸的水在球形部位会靠自身重量回落,不会引起倒吸,故B不符合;
C.烧瓶中导气管略露出胶塞,氨气通入引起倒吸后的水进入烧瓶,不会引发倒吸到上一发生装置,烧瓶起到安全瓶的作用,故C不符合;
D.氨气不溶于四氯化碳,导气管先插入四氯化碳,氨气上升遇到硫酸溶液被吸收,不会发生倒吸,故D不符合;
故选A.
点评 本题考查了氨气的吸收装置分析判断,注意氨气是极易溶于水的气体,对于极易溶于水的气体的防倒吸装置,注意有缓冲作用的装置能防止倒吸,题目难度不大.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 它们的氧化物都能与水反应生成对应的酸 | |
| B. | 碳和硅的最高正价都是+4价 | |
| C. | 硅元素在地壳中的含量占第二位,碳占第一位 | |
| D. | 碳和硅在自然界存在形式都是既有游离态也有化合态 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
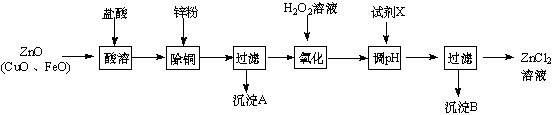
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 8.8 |
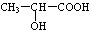 )生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为
)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为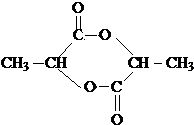 ,聚乳酸的结构简式为
,聚乳酸的结构简式为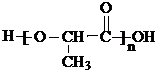 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 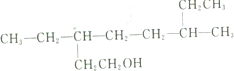 的名称为3,6-二乙基-1-庚醇 的名称为3,6-二乙基-1-庚醇 | B. | 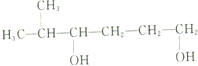 的名称为2-甲基-3,6-己二醇 的名称为2-甲基-3,6-己二醇 | ||
| C. | 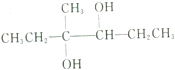 的名称为4-甲基-2,4-己二醇 的名称为4-甲基-2,4-己二醇 | D. | 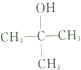 的名称为2-甲基-2-丙醇 的名称为2-甲基-2-丙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
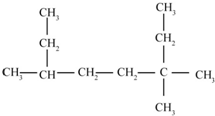 的名称为3,3,6-三甲基辛烷
的名称为3,3,6-三甲基辛烷 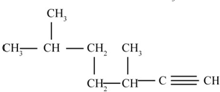 的名称为3,6-二甲基-1-庚炔
的名称为3,6-二甲基-1-庚炔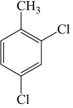 .
.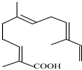 ,其分子式为C15H22O2.
,其分子式为C15H22O2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
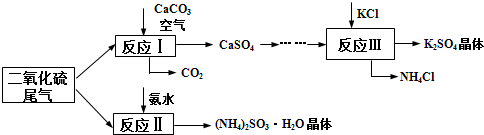
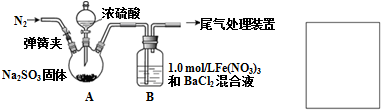
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元 素 | Mn | Fe | |
| 电离能 (kJ•mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com