
 而不能排布成
而不能排布成 其最直接的根据是( )
其最直接的根据是( )| A、能量最低原理 |
| B、泡利原理 |
| C、原子轨道构造原理 |
| D、洪特规则 |
科目:高中化学 来源: 题型:
| A、从2012年3月起公布了空气中的PM2.5:PM2.5是指空气中细颗粒物直径≤2.5 p m的颗粒物 |
| B、“可燃冰”的燃烧、从海水中提取镁、铜的电解精炼、石油分馏全都是化学变化的过程 |
| C、化合物是由不同种元素组成的纯净物,所以只含一种元素的物质一定不是化合物 |
D、原子结构模型的演变历史可表示为: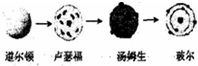 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据红外光谱图的分析可以初步判断有机物中具有哪些基团 |
| B、实验室制乙炔的反应是氧化还原反应 |
| C、“神州七号”的防护层中含聚四氟乙烯,聚四氟乙烯属于不饱和烃 |
| D、用酸性高锰酸钾溶液除去乙炔中含有的H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:
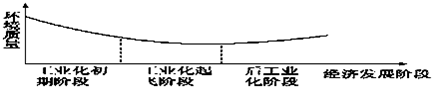
| A、环境污染不可避免,只能采取“先污染,后治理”的策略 |
| B、后工业化阶段环境问题会自然解决 |
| C、保护环境至关重要,必须杜绝兴建产生污染的工业设施 |
| D、应当采取措施减少或避免发展过程中的环境污染问题 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
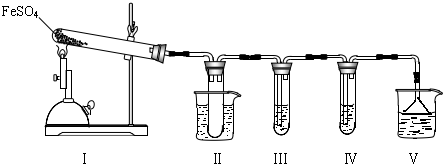
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中加入 | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置Ⅳ的试管中加入 |
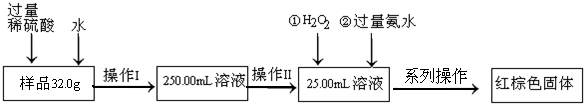
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、181:209 | B、28:44 |
| C、1:2 | D、1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丝绸与棉布(采用灼烧闻其气味的方法) |
| B、Na2SO4与NH4Cl(采用加碱加热闻其气味的方法) |
| C、NaCl与KCl(采用灼烧时观察焰色的方法) |
| D、K2CO3与K2SO4(采用加BaCl2观察有无沉淀产生的方法) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | ||
| SO2 | O2 | Ar | ||
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 2 | 1 | 0 | 放出热量:Q2 |
| 丙 | 2 | 1 | 0.5 | 放出热量:Q3 |
| A、Q1=Q3<Q2 |
| B、达到平衡时,乙容器中SO2的体积分数最大 |
| C、平衡时,甲、乙、丙3个容器中甲的平衡常数最小 |
| D、若在上述条件下,反应生成1mol SO3(s),则反应放热为98.5kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.
某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com