
| A£® | ¹čµÄŗ¬Įæ¾ÓµŚ¶žĪ»£¬ŌŚµŲĒņÉĻÓŠ·įø»µÄµ„ÖŹ¹č׏Ō“£¬ČēŹÆÓ¢”¢Ė®¾§”¢øÕÓńµÄÖ÷ŅŖ³É·Ö¶¼ŹĒSiO2 | |
| B£® | µ„¾§¹čŹĒŅ»ÖÖĮ¼ŗƵİėµ¼Ģå²ÄĮĻ£¬æÉÓĆÓŚÖĘŌģµēĄĀ | |
| C£® | “ę·ÅNaOHČÜŅŗµÄŹŌ¼ĮĘæÓ¦ÓĆ²£Į§Čū | |
| D£® | ¹čĻą¶ŌÓŚĒāĘų±ćÓŚŌĖŹä”¢Öü“ę£¬“Ó°²Č«½Ē¶Čæ¼ĀĒ£¬¹čŹĒÓŠæŖ·¢¼ŪÖµµÄČ¼ĮĻ |
·ÖĪö A£®ŅĄ¾ŻøÕÓńµÄÖ÷ŅŖ³É·ÖĪŖŃõ»ÆĀĮ½ā“š£»
B£®ÖĘŌģµēĄĀÓĆµÄ²ÄĮĻÓ¦¾ßÓŠĮ¼ŗƵĵ¼µēŠŌ£»
C£®ĒāŃõ»ÆÄĘÓė¶žŃõ»Æ¹č·“Ӧɜ³É¾ßÓŠÕ³ŠŌµÄ¹čĖįÄĘČÜŅŗ£»
D£®¹č³£ĪĀĻĀĪŖ¹ĢĢ壬ŠŌÖŹ½ĻĪČ¶Ø£¬±ćÓŚÖü“ę£¬½ĻĪŖ°²Č«£¬¹čŹĒÓŠæŖ·¢¼ŪÖµµÄČ¼ĮĻ£»
½ā“š ½ā£ŗA£®øÕÓńµÄÖ÷ŅŖ³É·ÖĪŖŃõ»ÆĀĮ£¬²»ŹĒ¶žŃõ»Æ¹č£¬¹ŹA“ķĪó£»
B£®ÖĘŌģµēĄĀÓĆµÄ²ÄĮĻÓ¦¾ßÓŠĮ¼ŗƵĵ¼µēŠŌ£¬¾§Ģå¹čĪŖ°ėµ¼Ģ壬²»ÄÜÓĆÓŚÖĘŌģµēĄĀ£¬¹ŹB“ķĪó£»
C£®²£Į§ÖŠŗ¬ÓŠ¶žŃõ»Æ¹č£¬ĒāŃõ»ÆÄĘÓė¶žŃõ»Æ¹č·“Ӧɜ³É¾ßÓŠÕ³ŠŌµÄ¹čĖįÄĘČÜŅŗ£¬ČŻŅ×½«²£Į§ČūÓė²£Į§ĘæÕ³µ½Ņ»æ飬ĖłŅŌ²»ÄÜÓĆ²£Į§Čū£¬¹ŹC“ķĪó£»
D£®¹č³£ĪĀĻĀĪŖ¹ĢĢ壬ŠŌÖŹ½ĻĪČ¶Ø£¬±ćÓŚÖü“ę£¬½ĻĪŖ°²Č«£¬¹čŹĒÓŠæŖ·¢¼ŪÖµµÄČ¼ĮĻ£¬¹ŹDÕżČ·£»
¹ŹŃ”£ŗD£®
µćĘĄ ±¾Ģāæ¼²éĮĖ¹č¼°Ęä»ÆŗĻĪļŠŌÖŹ£¬ŹģĻ¤¶žŃõ»Æ¹čĖįŠŌŃõ»ÆĪļµÄŠŌÖŹŹĒ½āĢā¹Ų¼ü£¬×¢Ņā¼īŠŌĪļÖŹ±£“ę×¢ŅāĪŹĢā£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| »ÆѧŹ½ | µēĄė³£Źż |
| HClO | Ka=3”Į10-8 |
| H2CO3 | Ka1=4.3”Į10-7 |
| Ka2=5.6”Į10-11 |
| A£® | c£ØHClO£©+c£ØClO-£©=c£ØHCO3-£©+c£ØH2CO3£© | B£® | c£ØNa+£©+c£ØH+£©=c£ØHCO3-£©+c£ØClO-£©+c£ØOH-£© | ||
| C£® | c£ØHCO3-£©£¾c£ØClO-£©£¾c£ØOH-£© | D£® | c£ØClO-£©£¾c£ØHCO3-£©£¾c£ØH+£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĘÕĶز£Į§ŪįŪö | B£® | ĢśŪįŪö | C£® | ŹÆÓ¢ŪįŪö | D£® | ĢÕ“ÉŪįŪö |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µē½ā¾«Į¶ĶµÄ¹ż³ĢÖŠ£¬Ć¾×ŖŅĘNAøöµē×ÓŹ±£¬Ńō¼«ČܽāĶµÄÖŹĮæĪŖ32g | |
| B£® | 1molNa2O2¹ĢĢåÖŠŗ¬Ąė×Ó×ÜŹżĪŖ4NA | |
| C£® | 1molōĒ»łÓė17g NH3Ėłŗ¬µē×ÓŹżÖ®±ČĪŖ9£ŗ10 | |
| D£® | 1molNa2CO3¾§ĢåÖŠŗ¬ŅõĄė×ÓŹżŠ”ÓŚ1NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
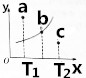 ijĪĀ¶ČĻĀµÄ2LĆܱÕČŻĘ÷ÖŠ·¢ÉśÄ³Ņ»ĢŲ¶Ø·“Ó¦£¬3ÖŠĘųĢåĘšŹ¼×“Ģ¬ŗĶĘ½ŗāדĢ¬Ź±µÄĪļÖŹµÄĮæ£Øn£©ČēĻĀ±ķĖłŹ¾£¬2sŹ±“ļµ½Ę½ŗāדĢ¬£®»Ų“šĻĀĮŠĪŹĢā£ŗ
ijĪĀ¶ČĻĀµÄ2LĆܱÕČŻĘ÷ÖŠ·¢ÉśÄ³Ņ»ĢŲ¶Ø·“Ó¦£¬3ÖŠĘųĢåĘšŹ¼×“Ģ¬ŗĶĘ½ŗāדĢ¬Ź±µÄĪļÖŹµÄĮæ£Øn£©ČēĻĀ±ķĖłŹ¾£¬2sŹ±“ļµ½Ę½ŗāדĢ¬£®»Ų“šĻĀĮŠĪŹĢā£ŗ| ĆܱÕČŻĘ÷ | A | B | C |
| n£ØĘšŹ¼×“Ģ¬£©/mol | 4 | 2 | 0 |
| n£ØĘ½ŗāדĢ¬£©/mol | 2.8 | 1.4 | 1.2 |
| ĆܱÕČŻĘ÷ | ¼× | ŅŅ | ±ū | ¶” | |
| ĆܱÕČŻĘ÷Ģå»ż/L | 2 | 2 | 2 | 1 | |
| ĘšŹ¼ĪļÖŹµÄĮæ | n£ØA£©/mol | 0.4 | 0.8 | 0.8 | 0.4 |
| n£ØB£©/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| AµÄĘ½ŗā×Ŗ»ÆĀŹ | 80 | ¦Į1 | ¦Į2 | ¦Į3 | |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

| ŃōĄė×Ó | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| æŖŹ¼³ĮµķŹ±µÄpH | 2.7 | 7.0 | - | - | - |
| ³ĮµķĶźČ«ŹĒµÄpH | 3.7 | 9.0 | 11.1 | 8 | 9£Ø£¾9Čܽā£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | HOCH2CH2Cl | B£® | CH3CH2OH | C£® | CH3COOH | D£® | 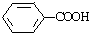 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÓĆCu×÷Ņõ”¢Ńōµē¼«£¬µē½āCuCl2ČÜŅŗ | |
| B£® | ÓĆCu×÷Ņõ”¢Ńōµē¼«£¬µē½āK2SO4ČÜŅŗ | |
| C£® | ĶŠæŗĻ½šŌŚ³±ŹŖæÕĘųÖŠ·¢Éśµē»ÆѧøÆŹ“ | |
| D£® | Cu×÷Ōµē³ŲµÄøŗ¼«£¬Ģ¼°ō×÷Õż¼«£¬NaClČÜŅŗ×÷µē½āÖŹČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com