
����Ŀ������Ҫ��ش��������⣺
��![]() ��
��![]() ��
�� ��
��![]() ��CH4��CH3CH2CH3 �����ʯ��ʯī ��H��D��T ���Ҵ���CH3CH2OH���ͼ��ѣ�CH3OCH3����������O3����������O2����
��CH4��CH3CH2CH3 �����ʯ��ʯī ��H��D��T ���Ҵ���CH3CH2OH���ͼ��ѣ�CH3OCH3����������O3����������O2���� ��
�� ��
��![]() ��
��![]() ��CuSO45H2O��CuSO43H2O
��CuSO45H2O��CuSO43H2O
��1����10�������У���ͬ�����������_____������ţ���ͬ������ͬλ�ص���_____����ͬ���칹�����_____����ͬһ���ʵ���_____����ͬϵ�����_____��
��2��д��֧��ֻ��һ���һ��������������С�������Ľṹ��ʽ___________________________��
��3��һ������ϡ�����ϡNaOH��Һ��Ӧ��������1molH2Oʱ�ų�������Ϊ57.3kJ�����к��ȵ��Ȼ�ѧ����ʽΪ_____________________________________________________________________��
��4����ʵ֤��������Ƴ�ԭ��صķ�Ӧͨ���Ƿ��ȷ�Ӧ�����л�ѧ��Ӧ�������Ͽ�����Ƴ�ԭ��ص���__________��
A��C��s��+H2O��g���TCO��g��+H2��g����H��0
B��2H2��g��+O2��g��=2H2O��l����H��0
C��NaOH��aq��+HCl��aq��=NaCl��aq��+H2O��l����H��0��
���𰸡��ܢߢݢڢޢ٢���![]() 1/2H2SO4��aq��+NaOH��aq��=1/2Na2SO4��aq��+H2O��l������H=��57.3kJ/molB
1/2H2SO4��aq��+NaOH��aq��=1/2Na2SO4��aq��+H2O��l������H=��57.3kJ/molB
��������
��1��ͬ��Ԫ���γɵIJ�ͬ���ʻ�Ϊͬ�������壻
��������ͬ��������������������ͬ��ԭ�ӻ���ͬλ�أ�
������ͬ����ʽ���ṹ��ͬ�Ļ����ﻥΪͬ���칹�壻
��ɺͽṹ����ͬ������Ϊͬһ���ʣ�ͬһ������ɡ��ṹ�����ʶ���ͬ���ṹʽ����״�����ʵľۼ�״̬���ܲ�ͬ��
ͬϵ��ָ�ṹ���ơ�ͨʽ��ͬ����������1���������ɸ�CH2ԭ���ŵĻ������������Ŀ��������ȣ�
��2�������г����һ������������ٺ���5��C���ݴ�д�����л���Ľṹ��ʽ��
��3�������к��ȵĸ��ϡ��ǿ���ǿ�Ӧ����1molˮ���ų���������д�к��ȵ��Ȼ�ѧ����ʽ��
��4������Ƴ�ԭ��صķ�Ӧͨ���Ƿ��ȷ�Ӧ���ұ��������Է����е�������ԭ��Ӧ��
��1������![]() ��
��![]() ������ṹ��ʽһ�£�Ϊͬһ�����ʣ�Ϊ2-�����飻
������ṹ��ʽһ�£�Ϊͬһ�����ʣ�Ϊ2-�����飻
��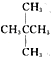 ��
��![]() ����ʽ��ͬC5H12���ṹ��ͬ��Ϊ̼���칹�������Ʒֱ�Ϊ��2��2-�������顢2-�����飬��Ϊͬ���칹�壻
����ʽ��ͬC5H12���ṹ��ͬ��Ϊ̼���칹�������Ʒֱ�Ϊ��2��2-�������顢2-�����飬��Ϊͬ���칹�壻
��CH4��CH3CH2CH3�ṹ���ƣ��������������γ�2��CH2ԭ���ţ���Ϊͬϵ�
�ܽ��ʯ��ʯī����̼Ԫ����ɵIJ�ͬ���ʣ���Ϊͬ�������壻
��H��D��T��������ͬ������Ԫ�صIJ�ͬ���أ���Ϊͬλ�أ�
���Ҵ���CH3CH2OH���ͼ��ѣ�CH3OCH3������ʽ��ͬC2H6O���ṹ��ͬ����Ϊͬ���칹�壻
�߳�����O3����������O2��������Ԫ����ɵIJ�ͬ���ʣ���Ϊͬ�������壻
��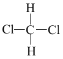 ��
�� ������ṹ��ʽһ�£�Ϊͬһ�����ʣ�
������ṹ��ʽһ�£�Ϊͬһ�����ʣ�
��![]() ��
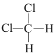
��![]() ������ṹ��ʽһ�£�Ϊͬһ�����ʣ�Ϊ2-�����飻
������ṹ��ʽһ�£�Ϊͬһ�����ʣ�Ϊ2-�����飻
��CuSO4��5H2O��CuSO4��3H2O��Ϊͭ�Σ��ᾧˮ������ͬ��ʲô�����ǣ�
�ʴ�Ϊ���ܢߣ��ݣ��ڢޣ��٢��ۣ�
��2�������к����һ������һ�������3��λ������ֻ��һ���һ���ʽ����С�������Ľṹ��ʽΪ![]() ��
��
��3���к���ָϡ��ǿ���ǿ�Ӧ����1molˮ���ų���������H2SO4��NaOH��Ӧ���к�����ָ��Ӧ����1molˮ�ų�57.3kJ����������Ӧ���Ȼ�ѧ����ʽΪ1/2H2SO4��aq��+NaOH��aq��=1/2Na2SO4��aq��+H2O��l������H=-57.3kJ��mol��1��
��4������Ƴ�ԭ��صķ�Ӧͨ���Ƿ��ȷ�Ӧ���ұ��������Է����е�������ԭ��Ӧ��
A���÷�Ӧ�����ȷ�Ӧ�����Բ�����Ƴ�ԭ��أ���A��ѡ��
B���÷�Ӧ�Ƿ��ȷ�Ӧ�����Է��Ľ���������ԭ��Ӧ����������Ƴ�ԭ��أ���Bѡ��
C���÷�Ӧ����������ԭ��Ӧ�����Բ�����Ƴ�ԭ��أ���C��ѡ��
��ѡB��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E�Ǻ˵����������������ֶ���������Ԫ�أ�AԪ�ص�ԭ�Ӻ���ֻ��1�����ӣ�BԪ�ص�ԭ�Ӱ뾶����������������С�ģ�B������������Ӧˮ����Ļ�ѧʽΪHBO3��CԪ��ԭ�ӵ������������ȴ�����4����C����������D�������Ӿ�����ͬ�ĵ����Ų�����Ԫ�ؿ��γɻ�����D2C��C��Eͬ���壮
��1��D�����ڱ��е�λ��______��B��ԭ�ӽṹʾ��ͼ______��
��2��EԪ���γ�����������Ӧ��ˮ����Ļ�ѧʽΪ______��
��3��Ԫ��C��D��E�γɵ�ԭ�Ӱ뾶��С��ϵ��______����Ԫ�ط��ű�ʾ����
��4��C��D���γɻ�����D2C2��D2C2���еĻ�ѧ����______��
��5��A��C����Ԫ���γɵ�ԭ�Ӹ���֮��Ϊ1��1�Ļ��������ʽ______��
��6��B���⻯����B������������ˮ���ﷴӦ�����ӷ���ʽ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������£���ˮ����ﵽƽ�����ˮ�������������ʺɴٽ�ˮ�ĵ������_____������ˮ�ĵ���ĵ������ _____
��Na2CO3 ��NaHSO4 �� ���� �� C2H5OH �� KNO3 �� H2CO3 ��AlCl3 �� SO3
��2����0.1mol/L �İ�ˮ����ͨ�����������������С�䣺
c(NH4+)/c(NH3��H2O ) ______ c(H+ )_____ ��ˮ����ת���� ____
��3���Ƚ�������Һ��pHֵ�������������
��0.1 mol��L- 1 NH4Cl��Һ___________0.01 mol��L- 1 NH4Cl��Һ
��0.1 mol��L- 1 Na2CO3��Һ __________0.1 mol��L- 1 NaHCO3��Һ
��25�棬1 mol��L- 1 FeCl3��Һ__________80�棬1 mol��L- 1 FeCl3��Һ
��0.1 mol��L- 1 NaOH ��Һ___________0.1 mol��L- 1 Na2CO3��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵijɷֱ�ʾ��ȷ����( )
A.ˮú������CH4B.�ѽ�������C2H6
C.��������(C6H10O5)nD.��֬����C17H35COOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��黯�����У���ѧ��������ȫ��ͬ����( )
A.NaCl�� H2SB.Na2O�� Na2O2
C.CO2 ��SO2D.HCl�� NaOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ��Br- ��ʽ�����ں�ˮ���������ԣ��У����ÿ����������Ӻ�ˮ�����壬��������ʾ�����¡�
![]()
���ϣ����������Һ̬�������ɫ���ӷ���
(1)�ữ������ˮ�ữ����ҪĿ���DZ���_______��д���ӷ�Ӧ����ʽ����
(2)���ȣ���ȥ���������в�����Cl2
�پ����������õ�������_______��
����Һʧȥ�������ú���FeBr2�����_______���������ûָ���
(3)��������ȡBr2��
��Na2CO3��Һ�����壬Br2�绯ΪBrO3- ��Br-������H2SO4�ữ�绯�����Һ�õ�Br2�������ӷ�Ӧ����ʽΪ_______��
(4)̽��(3)������H2SO4Ũ�ȶ�Br2���ɵ�Ӱ�죬ʵ�����£�
��� | A | B | C |
�Լ���� | 1 mol/L NaBr 20% H2SO4 | 1 mol/L NaBr 98% H2SO4 | ��B�з�Ӧ����Һ��ˮϡ�� |
ʵ������ | ���������� | ��Һ���غ�ɫ������ | ��Һ��ɫ��ú�dz |
��B����Һ���غ�ɫ˵��������_______��
�ڷ���C����Һ��ɫ��dz��ԭ��ͬѧ��Ϊ�Ƿ����˻�ѧ��Ӧ���£���ͬѧ��Ϊ����ˮϡ�����¡�����Ϊ��ͬѧ�ķ������������þ���ķ�Ӧ˵�����ɣ�����Ϊ��ͬѧ�ķ�����������һ�����ʵ�鷽��˵�������ɻ���_______��
���ữ�绯�����Һ��ѡ�õ�����______���ϡ���ᡱ��Ũ���ᡱ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(��)
A. ԭ�Ӻ�������Ų�ʽΪ1s2��ԭ�����������Ų�ʽΪ1s22s2��ԭ�ӻ�ѧ��������
B. Fe3+�����������Ų�ʽΪ3s23p63d5
C. ��̬ͭԭ�ӵ������ĵ����Ų�ͼ: ![]()
D. ��̬̼ԭ�ӵ����������Ų�ͼ:![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����H2��O2��������Na2CO3���ȼ�ϵ�أ����õ�ⷨ�Ʊ�Fe(OH)2��װ������ͼ��ʾ�����е����������Ϸֱ�Ϊ����ʯī��ͨ��һ��ʱ����Ҳಣ�����в��������İ�ɫ����������˵����ȷ����

A. ʯīI�缫��ӦΪH2��2e��+2OH��=2H2O
B. CO2��ʯī�缫���ϵõ���
C. X�缫����Ϊ��
D. NaCl��Һ��Cl������Y�缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У�����VIIA��Ԫ�ؽṹ�������������ǣ� ��
A.ԭ�����γ�-2��������
B.���ʾ�Ϊ˫ԭ�ӷ��ӣ�����������
C.ԭ�Ӱ뾶��ԭ������������С
D.�⻯����ȶ�����ԭ�ӵ��Ӳ�������������ǿ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com