
| 20g |
| 127g/mol |


科目:高中化学 来源: 题型:
| A、钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ |
| B、金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ |
| C、向Al2(SO4)3溶液中加入过量的氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| D、少量SO2通入漂白粉溶液中:SO2+H2O+Ca2++2ClO-═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 )是食品添加剂的增香原料,其合成路线如下:
)是食品添加剂的增香原料,其合成路线如下:

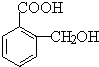 ,在一定条件下可以合成聚酯高分子,写出该聚酯高分子的结构简式
,在一定条件下可以合成聚酯高分子,写出该聚酯高分子的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
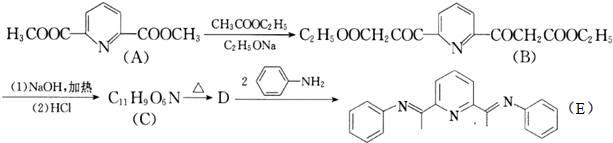
 )且环上只有2个取代基;
)且环上只有2个取代基; 和
和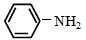 为原料合成西佛碱N-苯基苯甲亚胺(
为原料合成西佛碱N-苯基苯甲亚胺(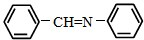 ),请你拟出合成路线:
),请你拟出合成路线:查看答案和解析>>
科目:高中化学 来源: 题型:
| 锥形瓶中的溶液 | 滴定管中的溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | 乙 |
| B | 酸 | 碱 | 甲基橙 | 甲 |
| C | 碱 | 酸 | 酚酞 | 甲 |
| D | 酸 | 碱 | 酚酞 | 乙 |

查看答案和解析>>
科目:高中化学 来源: 题型:
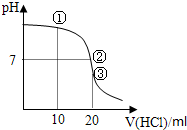
| A、①溶液:c(C1-)>c(NH4+)>c(OH-)>c(H+) |
| B、②溶液:c(NH4+)=c(C1-)>c(OH-)=c(H+) |
| C、③溶液:c(H+)>c(NH3?H2O)>c(OH-) |
| D、滴定过程中可能出现:c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
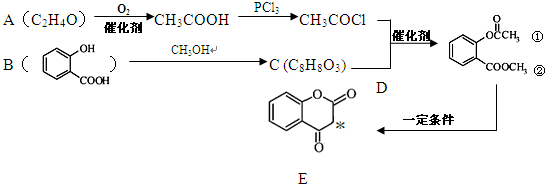
 )是一种重要的有机合成中间体.写出以苯酚、甲苯为基本原料制取该化合物的合成路线流程图.请注意:1.可选用必要的无机原料;2.已知酚羟基一般不易直接与羧酸发生类似酯化的反应,以上C→D的方法可供参照.
)是一种重要的有机合成中间体.写出以苯酚、甲苯为基本原料制取该化合物的合成路线流程图.请注意:1.可选用必要的无机原料;2.已知酚羟基一般不易直接与羧酸发生类似酯化的反应,以上C→D的方法可供参照.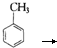
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com