
| A. | 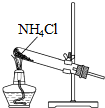 制取氨气 | B. | 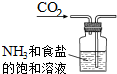 制取NaHCO3 | C. | 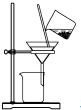 分离NaHCO3 | D. | 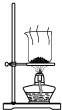 干燥NaHCO3 |
分析 A.氯化铵不稳定,加热易分解,温度稍低又可生成氯化铵;
B.气体通入方向错误;
C.从溶液中分离碳酸氢钠固体,可用过滤的方法;
D.碳酸氢钠不稳定,不能直接加热干燥.
解答 解:A.氯化铵不稳定,加热易分解,温度稍低又可生成氯化铵,制备氨气,应用氯化铵和氢氧化钙为反应物,故A错误;
B.应将二氧化碳从长导管进入,否则将液体排出,故B错误;
C.从溶液中分离碳酸氢钠固体,可用过滤的方法,故C正确;
D.碳酸氢钠不稳定,不能直接加热干燥,可烘干,故D错误.
故选C.
点评 本题考查较为综合,涉及物质的分离、提纯以及制备,为高考常见题型,侧重于学生的分析、实验能力的考查,注意把握实验的严密性和可行性的评价,难度不大.


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
| 温度/℃ | 300 | 727 | 1 227 |
| lg K | 6.17 | 2.87 | 1.24 |
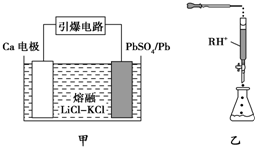
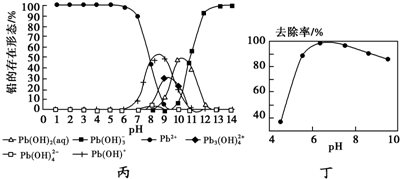
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L臭氧与22.4L氢气所含原子数均为2NA | |
| B. | 46gNO2和N2O4的混合气体中含有的原子数为3NA | |
| C. | 2.24LCH4所含电子数为NA | |
| D. | 1molO2参加反应转移的电子数一定为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
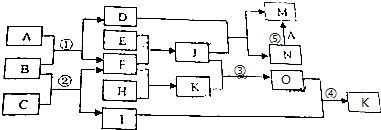
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
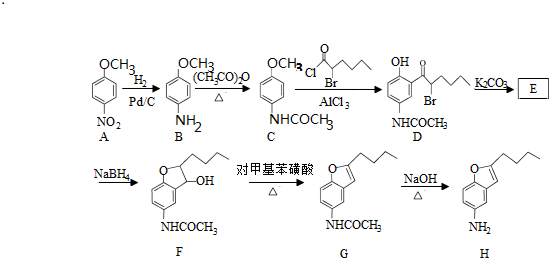
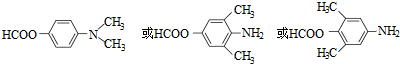 .
.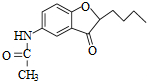 .
.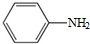 )易被氧化
)易被氧化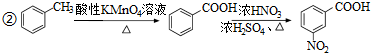
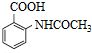 ,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).
,写出制备的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
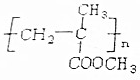 ,此物质与氢氧化钠共热后加入盐酸,能得到两种有机产物,下列物质与产物之一互为同分异构体( )
,此物质与氢氧化钠共热后加入盐酸,能得到两种有机产物,下列物质与产物之一互为同分异构体( )| A. | 丁酸 | B. | CH2=CHCH2COOH | C. | 甲酸丙酯 | D. | 丙烯酸甲酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
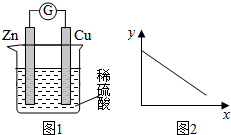
| A. | 铜棒的质量 | B. | c(Zn2+) | C. | c(H+) | D. | c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ①②③④⑥ | C. | 只有①②③ | D. | 只有②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com