
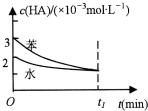
 常温下,将一定量的一元有机弱酸:HA加入到100mL水与100mL苯的混合体系中,HA在水中部分电离:HA?H++A-,在苯中则部分发生双聚反应:2HA?(HA)2.在水和苯中,HA的起始浓度及平衡浓度关系如图所示.下列有关该混合体系说法正确的是( )
常温下,将一定量的一元有机弱酸:HA加入到100mL水与100mL苯的混合体系中,HA在水中部分电离:HA?H++A-,在苯中则部分发生双聚反应:2HA?(HA)2.在水和苯中,HA的起始浓度及平衡浓度关系如图所示.下列有关该混合体系说法正确的是( )| A. | HA在水中的电离速率大于其在苯中的双聚速率 | |
| B. | t1时刻在水中和苯中c(A-)相同 | |
| C. | 向上述的混合体系中加入少量水和苯的混合物,则两平衡均正移,c(HA)均减小 | |
| D. | 用10mL 0.05mol•L-1的NaOH溶液可恰好中和混合体系中的HA |
分析 A.由图象可知,在相同时间内,在苯中HA的浓度变化值大;
B.在苯中不存在A-;
C.水溶液中促进了电离,平衡向着正向移动,苯体系中平衡向着分子数增大的方向移动;
D.计算混合物中HA的物质的量,HA与NaOH等物质的量反应.
解答 解:A.由图象可知,在相同时间内,在苯中HA的浓度变化值大,所以HA在水中的电离速率小于其在苯中的双聚速率,故A错误;
B.在苯中则部分发生双聚反应:2HA?(HA)2,所以在苯中不存在A-,故B错误;
C.向上述的混合体系中加入少量水和苯的混合物,水溶液中浓度越小,电离程度越大,则上述平衡正移,且c(HA)减小;而苯溶液中稀释过程,平衡将向分子数增大方向移动,即向逆方向移动,但c(HA)会减小,故C错误;
D.10mL 0.05mol•L-1的NaOH溶液中n(NaOH)=0.0005mol,混合体系中的HA的物质的量为0.0005mol,则HA与NaOH等物质的量恰好反应,故D正确.
故选D.
点评 本题考查了弱电解质的电离,明确弱电解质的电离特点以及图象中所给的信息是解本题关键,考查学生知识迁移能力、分析能力、以及对信息的提取应用能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
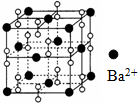
| A. | 该晶体为分子晶体 | |
| B. | 晶体的化学式为Ba2O2 | |
| C. | 该晶体晶胞结构与CsCl相似 | |
| D. | 与每个Ba2+距离相等且最近的Ba2+共有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数:c>d | B. | 氢化物的稳定性:H2Y>HZ | ||
| C. | 离子的氧化性:X+<W3+ | D. | 原子半径:X<W |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
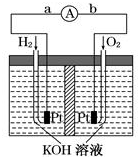 氢氧燃料电池是符合绿色化学理念的新型发电装置,图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置,图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、
、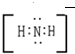 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把浑浊的液体倒入蒸发皿中加热 | |
| B. | 开始析出晶体后用玻璃棒搅拌 | |
| C. | 待水分完全蒸干后停止加热 | |
| D. | 蒸干水分后用玻璃棒转移固体至滤纸上 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com