
| A. | SO3与HCHO | B. | BF3与NH3 | C. | BeCl2与SCl2 | D. | H2O与SO2 |
分析 根据价层电子对互斥理论确定中心原子杂化类型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.
解答 解:A.三氧化硫分子中S原子价层电子对个数=3+$\frac{1}{2}$×(6-3×2)=3,所以采用sp2杂化;甲醛分子中C原子价层电子对个数是3+$\frac{1}{2}$×(4-1×2-2×1)=3,所以采用sp2杂化,为sp2杂化,二者杂化类型相同,故A正确;
B.BF3中B原子价层电子对个数=3+$\frac{1}{2}$×(3-3×1)=3,所以采用sp2杂化;NH3中N原子价层电子对个数=3+$\frac{1}{2}$×(5-3×1)=4,所以采用sp3杂化,二者杂化方式不同,故B错误;
C.氯化铍中Be原子价层电子对个数=2+$\frac{1}{2}$×(2-2×1)=2,所以采用sp杂化;二氯化硫中S原子价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,所以采用sp3杂化,二者杂化方式不同,故C错误;
D.水分子中O原子价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4,所以采用sp3杂化;二氧化硫中S原子价层电子对个数=2+$\frac{1}{2}$×(6-2×2)=3,所以采用sp2杂化,二者杂化方式不同,故D错误;
故选A.
点评 本题考查原子杂化方式判断,为高频考点,明确价层电子对互斥理论即可解答,难点是孤电子对计算方法.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | NH4H是离子化合物 | |
| B. | NH4H溶于水,所形成的溶液显酸性 | |
| C. | NH4H与水反应时,NH4H是还原剂 | |
| D. | NH4H固体投入少量的水中,有两种气体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | 只有② | C. | ①②③的混合物 | D. | ①②③④的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe Cu Al Ag Mg | B. | Al Cu Mg Ag Fe | ||
| C. | Mg Cu Al Ag Fe | D. | Mg Ag Al Cu Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
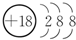 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
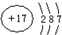 ,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024
,含1mol X 的氧化物晶体中含有共价键数目为4NA或2.408×1024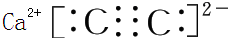
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 科学家最近在-100℃的低温下合成了一种烃X,红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了分子的球棍模型.如图,下列说法中不正确的是( )
科学家最近在-100℃的低温下合成了一种烃X,红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了分子的球棍模型.如图,下列说法中不正确的是( )| A. | 该烃X与等质量的甲烷相比,X燃烧时消耗的氧气更多 | |
| B. | 分子中碳原子的化学环境有2种 | |
| C. | 分子中的氢原子分布在两个相互垂直的直线上 | |
| D. | 分子中有C-C键,也有C=C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOD,C2H5OD | B. | CH3COONa,C2H5OD,HOD | ||
| C. | CH3COONa,C2H5OH,HOD | D. | CH3COONa,C2H5OD,H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com