
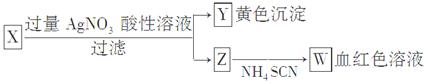
| A.Z中一定有Fe3+ | B.X中一定有Fe2+ |
| C.Y为AgBr沉淀 | D.X一定为FeBr2 |
科目:高中化学 来源:不详 题型:填空题
 称为铁酸盐(含有FeO42-)。
称为铁酸盐(含有FeO42-)。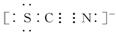
 3+氧化为FeO42-,请写出该离子反应方程式__________。
3+氧化为FeO42-,请写出该离子反应方程式__________。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
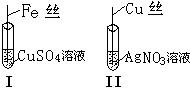
 是
是  ;
; ;
;查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.15mol/L | B.0.3mol/L | C.0.225mol/L | D.无法计算 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验步骤 | 预期现象和结论 |
| | |
| | |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
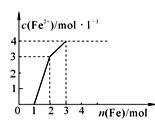
| A.2∶1∶4 | B.1∶2∶4 |
| C.1∶2∶1 | D.1∶1∶4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 剩余固体的组成 | m的取值范围 | n的取值范围 |
| 只有铜 | | |
| 有铁且有铜 | | (用含m的代数式表示) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com