
【题目】下列实验中,实验设计或所选装置合理的是( )
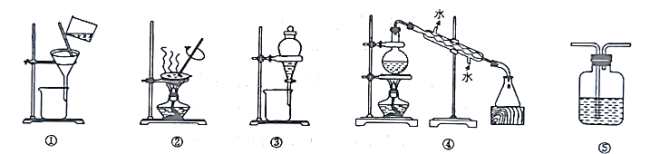
A.用乙醇提取碘水中的碘,应选择图③所示装置
B.用图①和图②所示装置进行粗盐提纯
C.用图④所示装置进行石油分馏实验制取汽油
D.图⑤所示装置中盛有饱和![]() 溶液,用于除去
溶液,用于除去![]() 中含有的少量
中含有的少量![]()
科目:高中化学 来源: 题型:
【题目】现有一份含有FeCl3和FeCl2的固体混合物,某化学兴趣小组为测定各成分的含量进行如下两个实验:
实验1 ①称取一定质量的样品,将样品溶解;
②向溶解后的溶液中加入足量的AgNO3溶液,产生沉淀;
③将沉淀过滤、洗涤、干燥得到白色固体28.7 g
实验2 ①称取与实验1中相同质量的样品,溶解;
②向溶解后的溶液中通入足量的Cl2;
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀;
④将沉淀过滤、洗涤后,加热灼烧到质量不再减少,得到固体Fe2O36.40g
根据实验回答下列问题:
(1)溶解过程中所用到的玻璃仪器有________
(2)实验室保存FeCl2溶液时通常会向其中加入少量的铁粉,其作用是_________
(3)用化学方程式表示实验2的步骤②中通入足量Cl2的反应:___________
(4)用容量瓶配制实验所用的NaOH溶液,下列情况会使所配溶液浓度偏高的是(填序号)_______。
a.未冷却溶液直接转移
b.没用少量蒸馏水洗涤烧杯和玻璃棒2~3次并转入容量瓶
c.加蒸馏水时,不慎超过了刻度线
d.砝码上沾有杂质
e.容量瓶使用前内壁沾有水珠
(5)检验实验2的步骤④中沉淀洗涤干净的方法是___________
(6)该小组每次称取的样品中含有FeCl2的质量为_________g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C、H、O、N 是构成生命的基本元素,是中学化学研究的重要内容之一。
(1)对碳原子核外两个未成对电子的描述,正确的是_____
A. 电子云形状不同
B. 自旋方向相同
C. 能量不同
D. 在同一轨道
(2)C、O、N 三种元素第一电离能由大到小的顺序是_____
(3)HCHO 分子中碳原子轨道的杂化类型是_____,福尔马林(HCHO 的水溶液),HCHO 极易与水互溶的主要原因是_____
(4)在有机银镜反应实验中其中一种反应物是配合物,写出此配合物离子的结构简式_____,提供孤电子对的成键原子是_____。
(5)如图是金刚石晶胞,每个碳原子的配位数是_____;每个晶胞中含有的碳原子个数是_____;若晶胞的边长是anm,该晶胞中两个碳原子之间的最短距离为_____nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述错误的是( )
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 有机物C7H8O属于芳香族化合物的同分异构体有6种
C. 立体烷![]() 的二氯代物有3种
的二氯代物有3种
D. 菲的结构简式为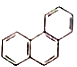 ,它的一硝基取代物有5种
,它的一硝基取代物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个实验室制取氯气并以氯气为原料进行一系列反应的装置,回答下列问题。(已知:①MnO2+4HCl(浓) ![]() MnCl2+2H2O+Cl2↑,②Cl2+SO2+2H2O=2HCl+H2SO4,③ Ba(OH)2+CO2=BaCO3↓+H2O)
MnCl2+2H2O+Cl2↑,②Cl2+SO2+2H2O=2HCl+H2SO4,③ Ba(OH)2+CO2=BaCO3↓+H2O)

(1)写出a仪器的名称___;
(2)装置D产生白色沉淀现象的原因___________;
(3)E装置的硬质玻璃管内盛有碳粉,发生氧化还原反应,其产物为CO2和HCl。试写出E中反应的化学方程式_______;
(4)F处的烧杯溶液中最终___(填“有”或“没有”)白色沉淀;
(5)F装置无法确认E处反应中有CO2产生,为了证明CO2的存在,要对F装置进行改造,下列装置符合要求的是___。

查看答案和解析>>
科目:高中化学 来源: 题型:
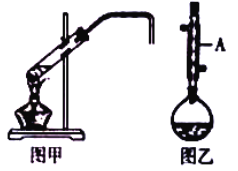
【题目】化学实验小组欲在实验室制备溴乙烷(图甲)和1﹣溴丁烷(图乙),涉及化学反应如下:
NaBr+H2SO4═HBr+NaHSO4 ①
C2H5﹣OH+HBrC2H5﹣Br+H2O ②
CH3CH2CH2CH2﹣OH+HBrCH3CH2CH2CH2﹣Br+H2O ③
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br﹣被浓硫酸氧化为Br2等。有关数据列表如下;
乙醇 | 溴乙烷 | 正丁醇 | 1﹣溴丁烷 | |
密度/gcm﹣3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
沸点/℃ | 78.5 | 38.4 | 117.2 | 111.6 |
请回答下列问题:
(1)图乙中仪器A的名称为_____。
(2)乙醇的沸点高于溴乙烷的沸点,其原因是_____。
(3)将1﹣溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在_____(填“上层”、“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必需进行稀释,其目的是_____。(填字母)
A.减少副产物烯和醚的生成
B.减少Br2的生成
C.减少HBr的挥发
D.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是_____。(填字母)
A.NaIB.NaOHC.NaHSO3D.KCl
(6)制备溴乙烷(图甲)时,采用边反应边蒸出产物的方法,其有利于_____;但制备1﹣溴丁烷(图乙)时却不能边反应边蒸出产物,其原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知还原性:Fe2+>Br-。向100mLFeBr2溶液中通入3.36L(标准状况)Cl2,反应后的溶液中Cl-和Br-的物质的量浓度相等,则原溶液中FeBr2的物质的量浓度为( )
A. 2 mol·L-1 B. 1.5 mol·L-1 C. 1 mol·L-1 D. 0.75 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 四种可溶性物质,它们的阳离子可能分别是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子可能分别是NO3-、SO42-、OH-、CO32-中的某一种。
①若把4种物质分别溶解于盛有蒸馏水的4支试管中,均得澄清溶液,只有B溶液呈蓝色。
②若向①的4支试管中分别加盐酸,C溶液中有沉淀产生,A溶液中有无色无味气体逸出。
(1)根据①②的事实推断B、C的化学式分别为_________、_________。
(2)写出上述实验中C与盐酸的反应化学方程式:_________。
(3)将A溶液与D溶液混合使之恰好完全反应,将反应后混合物中两种物质分离的方法是_________。在所得溶液中加入铝片,发生的离子反应方程式为:_________。
(4)A与稀硫酸反应生成的气体x用排空法收集,测得体积为8.96 L(标准状况下),质量为15.2 g,该混合气体平均摩尔质量为_________,混合气体中x气体的体积分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示,下列表述正确的是( )
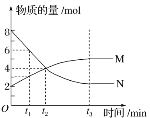
A. 化学方程式:2M![]() N
N
B. t2时,正逆反应速率相等,达到平衡
C. t3时,正反应速率大于逆反应速率
D. t1时,N的浓度是M浓度的2倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com