
分析 对于AgCl(s)?Ag++Cl-,平衡后欲使溶液中的[Cl-]增大,可加入可溶性氯化物,或加入与Ag+反应的物质,使平衡正向移动,另外加热促进溶解,以此解答该题.
解答 解:①加氨水,与Ag+发生络合反应生成银氨络离子,平衡正向移动,可氯离子浓度增大,故正确;
②加水,如仍为饱和溶液,则离子浓度不变,如为不饱和溶液,则浓度减小,故错误;
③加NaCl(s),可使氯离子浓度增大,故正确;
④加AgCl(s),平衡不移动,氯离子浓度不变,故错误;
⑤加NaBr(s),生成AgBr沉淀,平衡正向移动,氯离子浓度增大,故正确;
⑥加热,促进溶解,氯离子浓度增大,故正确.
故答案为:①③⑤⑥.
点评 本题考查难溶电解质的溶解平衡,为高频考点,侧重考查学生的分析能力,注意把握影响平衡移动的因素,难度不大.


 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤⑥ | B. | ③⑤⑥ | C. | ①③⑤⑥⑦ | D. | ③⑤⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备环己酮的反应原理:
实验室制备环己酮的反应原理: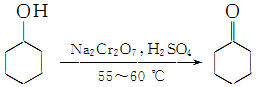 (实验装置如图所示,环己醇、环己酮、饱和食盐水和水的部分物理性质见表).
(实验装置如图所示,环己醇、环己酮、饱和食盐水和水的部分物理性质见表).| 物质 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1 | 0.962 | 能溶于水 |
| 环己酮 | 155.6 | 0.948 | 微溶于水 |
| 饱和食盐水 | 108.0 | 1.330 | - |
| 水 | 100.0 | 0.998 | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | 盐酸:强电解质 | Cl2:非电解质 | CaCO3:弱电解质 |
| B | CuSO4•5H2O:纯净物 | Al(OH)3:一元酸 | HD:单质 |
| C | Al2O3:离子化合物 | NaHCO3:正盐 | Na2O2:碱性氧化物 |
| D | 血液:胶体 | NO2:酸性氧化物 | H2O和D2O:混合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .(铋元素与氮元素同主族)
.(铋元素与氮元素同主族)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-(配离子)物质的量浓度的对数.
如图所示,横坐标为溶液的pH,纵坐标为Zn2+或[Zn(OH)4]2-(配离子)物质的量浓度的对数.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲装置:可用来证明碳酸的酸性比硅酸强 | |
| B. | 乙装置:橡皮管的作用是能使水顺利流下 | |
| C. | 丙装置:用图示的方法不能检查此装置的气密性 | |
| D. | 丁装置:先从①口进气集满二氧化碳,再从②口进气,可收集氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-396 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)=2H2O (l)△H=-286 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)=CO2(g)+2H2O (g)△H=-896 kJ•mol-1 | |
| D. | CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-736 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | b电极是负极 | |
| B. | 供电时的总反应为:2H2+O2═2H2O | |
| C. | 工作时溶液中阴离子移向正极 | |
| D. | 工作时正极区pH升高,负极区pH降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com