
| A. | 1mol任何物质都含有约6.02×1023个原子 | |
| B. | 0.012kg12C含有约6.02×1023个碳原子 | |
| C. | 1个氧原子的实际质量约为$\frac{6.02×1{0}^{23}}{32}$g | |
| D. | 3molOH-的质量为51g |
分析 A.物质并不都是由原子构成的,有的由分子构成,有的由离子构成;
B.0.012kg12C含有阿伏伽德罗常数个碳原子;
C.氧原子摩尔质量为16g/mol,1mol氧原子约含有6.02×1023个氧原子;
D.OH-的摩尔质量为17g/mol,根据m=nM计算其质量.
解答 解:A.物质并不都是由原子构成的,有的由分子构成,有的由离子构成,故A错误;
B.0.012kg12C含有阿伏伽德罗常数个碳原子,含有约6.02×1023个碳原子,故B正确;
C.氧原子摩尔质量为16g/mol,1mol氧原子约含有6.02×1023个氧原子,1个氧原子的实际质量约为$\frac{16}{6.02×1{0}^{23}}$g,故C错误;
D.OH-的摩尔质量为17g/mol,3molOH-的质量为3mol×17g/mol=51g,故D正确,
故选:AC.
点评 本题考查物质的量及其有关计算、阿伏伽德罗常数,比较基础,注意使用物质的量应指明具体的物质或微粒.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | 原子核外L层电子数是K层的2倍 |
| B | 其一种单质被称为地球生物的“保护伞” |
| C | 元素的第一电离能是第3周期所有元素中最小的 |
| D | 基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
| E | 可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
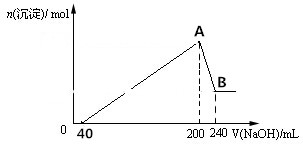
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
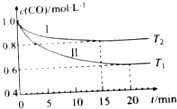 为了减少CO对大气的污染,某科研小组在一个体积为1L的容积不变的密闭容器中充入等量的CO和H2O(g),研究用CO和H2O(g)反应转化为绿色能源H2,不同温度下,CO的浓度[c(CO)]随时间[t]变化的曲线如图所示.
为了减少CO对大气的污染,某科研小组在一个体积为1L的容积不变的密闭容器中充入等量的CO和H2O(g),研究用CO和H2O(g)反应转化为绿色能源H2,不同温度下,CO的浓度[c(CO)]随时间[t]变化的曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com