
【题目】请根据要求填空:
(1)将0.10mol/L NH3H2O溶液稀释10倍,则稀释后的溶液中c(OH﹣)____原来的十分之一(填“大于”、“小于”或“等于”).
(2)实验测得0.10mol/L CH3COONH4溶液的pH=7,则c(CH3COO-)_____c(NH4+)(填写同上).
(3)利用反应:I2+2Na2S2O3=Na2S4O6+2NaI可以定量测定市售硫代硫酸钠(M=158)的纯度,现在称取7.900g硫代硫酸钠固体样品,配成250mL的溶液,取25.00mL置于锥形瓶中,加入指示剂,用含有I2为 0.1000mol/L的碘水滴定,消耗碘水20.00mL,则:
①滴定应选择的指示剂是____________,滴定终点的现象是:____________________________
②对于该滴定实验的有关操作或误差分析正确的是(_______)
A.滴定前,应对滴定管、锥形瓶进行润洗操作
B.滴定过程中,标准液滴到锥形瓶外,会使所测结果偏大
C.滴定管在滴定开始时尖嘴有气泡,滴定完成后气泡消失,则所测得的纯度将会偏小
D.滴定前仰视读数而滴定结束时平视读数,则所测得的纯度将会偏小
③样品中硫代硫酸钠纯度为______________________________
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若混合前Na2CO3溶液的浓度为2×10-4mol/L,则生成沉淀加入CaCl2溶液的最小浓度为______ mol/L。
【答案】大于 等于 淀粉溶液 溶液颜色由无色变成蓝色,且半分钟内不褪色 BD 80% 5.6×10-5
【解析】
(1)加水稀释,一水合氨的电离平衡向右移动,即电离被促进,电离出更多的氢氧根;
(2)根据电荷守恒c(OH﹣)+c(CH3COO﹣)= c(H+)+ c(NH4+),溶液的pH=7,即c(OH﹣)=c(H+),故c(CH3COO﹣)=c(NH4+);
(3)①淀粉遇到单质碘变蓝色;根据溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
②根据c(待测)=![]() 分析不当操作对相关物理量的影响,以此判断浓度的误差;
分析不当操作对相关物理量的影响,以此判断浓度的误差;
③求出硫代硫酸钠的质量,样品中硫代硫酸钠纯度=![]() ×100%;
×100%;
(3)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1×10-4mol/L,根据Ksp=c(CO32-)c(Ca2+)计算沉淀时混合溶液中c(Ca2+),原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍。
(1)加水稀释,一水合氨的电离平衡向右移动,即电离被促进,电离出更多的氢氧根,故将0.10mol/L NH3H2O溶液稀释10倍,则稀释后的溶液中c(OH﹣)大于原来的十分之一,故答案为:大于。
(2)根据电荷守恒可以知道:c(OH﹣)+c(CH3COO﹣)= c(H+)+ c(NH4+),0.10mol/L CH3COONH4溶液的pH=7,即c(OH﹣)=c(H+),故有c(CH3COO﹣)=c(NH4+),故答案为:等于。
(3)①淀粉遇到单质碘变蓝色,滴定前可以选择淀粉做指示剂,滴定终点的现象为溶液颜色由无色变成蓝色,且半分钟内不褪色,故答案为:淀粉;溶液颜色由无色变成蓝色,且半分钟内不褪色。
②A.滴定前,对滴定管、锥形瓶进行润洗,待测液的物质的量偏大,造成V(标准)偏大,根据![]() 分析,c(待测)偏高,故A错误;
分析,c(待测)偏高,故A错误;
B.滴定过程中,标准液滴到锥形瓶外,造成V(标准)偏大,根据c(待测)=![]() 分析,c(待测)偏高,故B正确;
分析,c(待测)偏高,故B正确;
C.滴定管在滴定开始时尖嘴有气泡,滴定完成后气泡消失,造成V(标准)偏大,根据c(待测)=![]() 分析,c(待测)偏高,待测液的物质的量偏大,则所测得的纯度将会偏大,故C错误;
分析,c(待测)偏高,待测液的物质的量偏大,则所测得的纯度将会偏大,故C错误;
D.滴定前仰视读数而滴定结束时俯视读数,造成V(标准)偏小,根据c(待测)=![]() 分析,c(待测)偏低,待测液的物质的量偏低,则所测得的纯度将会偏小,故D正确。
分析,c(待测)偏低,待测液的物质的量偏低,则所测得的纯度将会偏小,故D正确。
故答案为:BD。
③根据I2+2Na2S2O3=Na2S4O6+2NaI,n(I2)=0.1000mol/L×20.00×10-3L=2×10-3mol,知消耗的Na2S2O3的物质的量=2n(I2)=2×0.1000mol/L×20.00×10-3L=4×10-3mol,根据现称取7.900g硫代硫酸钠固体样品配成250mL的溶液,取25.00mL置于锥形瓶中,则被滴定的硫代硫酸钠质量为0.7900g,故样品中硫代硫酸钠纯度为![]() =
=![]() ×100%=80%,故答案为:80%。
×100%=80%,故答案为:80%。
(3)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1/2×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)c(Ca2+)=2.8×10-9可知,c(Ca2+)=2.8×109/1×104mol/L=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L,
故答案为:5.6×10-5mol/L。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】中华文化源远流长、博大精深。从化学的视角看,下列理解不正确的是( )
A. “千淘万漉虽辛苦,吹尽黄沙始到金”中“淘”“漉”相当于分离提纯操作中的“过滤”
B. 司母戊鼎属青铜制品,是我国古代科技光辉成就的代表之一
C. 瓷器(China)属硅酸盐产品,China一词又指“瓷器”,这反映了在西方人眼中中国作为“瓷器故乡”的形象
D. 侯德榜是我国化学工业的奠基人,主要成就: 侯氏制碱法,该碱指的是烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《茉莉花》是一首脍炙人口的中国民歌。茉莉花香气的成分有多种,乙酸苯甲酯 ( )是其中的一种,它可以从茉莉花中提取,也可以乙烯和甲苯为原料进行人工合成。其中一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以乙烯和甲苯为原料进行人工合成。其中一种合成路线如下:
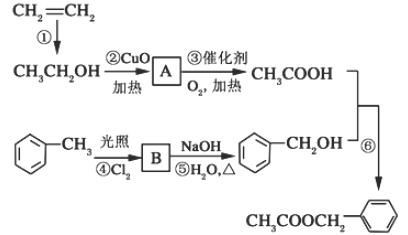
回答下列问题:
(1)B的结构简式为____________,A中官能团名称为____________;
(2)写出反应②、⑥的化学方程式_________________,__________________;
(3)上述反应中属于取代反应的有________(填写序号);
(4) 乙酸苯甲酯 ( )满足下列条件的同分异构体有________种。
)满足下列条件的同分异构体有________种。
A.属于芳香族化合物 B.苯环上只有一个支链 C.能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大___min(填0~1、1~2、2~3、3~4、4~5)。反应开始后反应速率先增大的原因是__。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率__________(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入少量的下列溶液以减慢反应速率,你认为不可行的是_。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图
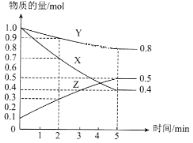
①该反应的化学方程式是__________。
②该反应达到平衡状态的标志是__________。
A.X、Y、Z的反应速率相等 B.容器内气体密度保持不变 C.容器内气体压强保持不变 D.消耗3molX的同时生成1mol Y
③2min内X的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的可再生能源.
(1)利用二氧化碳合成甲醇来替代汽油。
已知:2CH3OH(l) +3O2(g)=4H2O(l)+2CO2(g) △H=—1453.0 kJ/mol,2H2(g) + O2(g)=2H2O(l) △H=—571.6 kJ/mol
计算CO2(g)+3H2(g) =CH3OH(l)+ H2O(l)的反应热△H=___________ kJ/mol。
(2)下图是反应CO(g)+2H2(g)![]() CH3OH(g)中CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线.从反应开始至达到平衡时,用H2表示的反应速率v(H2)=______________.
CH3OH(g)中CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线.从反应开始至达到平衡时,用H2表示的反应速率v(H2)=______________.
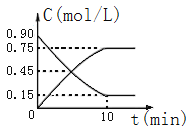
(3)在一恒容的密闭容器中充入1mol CO和2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g)△H并达到平衡,CO的平衡转化率随温度(T)、压强(P)的变化曲线如图所示.
CH3OH(g)△H并达到平衡,CO的平衡转化率随温度(T)、压强(P)的变化曲线如图所示.
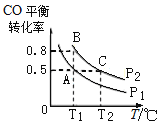
①能判断该反应达到化学平衡状态的是_____(填选项字母).
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.H2的转化率和CO的转化率相等
D.混合气体的平均相对分子质量不再改变
②比较平衡常数KA、KB、KC的大小:____________
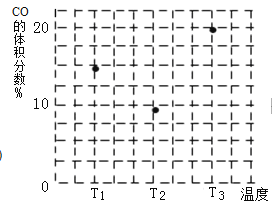
(4)在容积均为V L的甲、乙、丙三个密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时三个容器中一定处在化学平衡状态的是________(填“T1”或“T2” 或“T3”);
(5)电化学在我们的生产生活中占有越来越重要的地位。
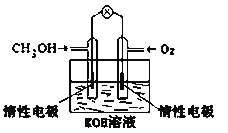
①燃料电池是一种绿色环保、高效的化学电源。图为甲醇燃料电池,则负极反应式为_____________。
②用甲醇燃料电池电解300mL饱和食盐水(惰性电极),则电解的离子方程式为____________________,电解一段时间后,当溶液的pH值为13时,消耗O2的质量为_______g。(忽略溶液体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_____Ⅰ1(Cu)(填“大于”或“小于”)。原因是_____________________________。
(3)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________,SO42-、CS2、CO32-键角由大到小的顺序是______________________
(4)锌冶炼过程中会产生污染性气体二氧化硫,已知液态二氧化硫也可以发生类似水的自身电离2SO2![]() SO2++SO32-,S和O两种元素中电负性较强的是______________,与SO2+互为等电子体的单质分子是________(填化学式),SO2+中σ键和兀键数目比为___________。
SO2++SO32-,S和O两种元素中电负性较强的是______________,与SO2+互为等电子体的单质分子是________(填化学式),SO2+中σ键和兀键数目比为___________。
(5)分析并比较物质A: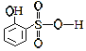 与B:
与B: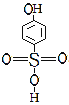 的沸点高低及其原因:__
的沸点高低及其原因:__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.钠和冷水反应:Na+2H2O=Na++2OH-+H2↑
B.金属铝溶于氢氧化钠溶液:Al+2OH-=![]() +H2↑
+H2↑
C.金属铝溶于盐酸中:2Al+6H+=2Al3++3H2↑
D.碳酸氢钠溶液中滴入少量的氢氧化钙溶液:HCO3-+OH-= CO32-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液的pH=_____________。
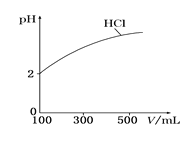
(2)体积均为100 mL、pH均为2的盐酸与一元弱酸HX,加水稀释过程中盐酸的pH与溶液体积的关系如图所示,则在图上画出HX加水至500mL稀释过程中pH值的变化曲线_____,并说明理由___________。
(3)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
25 ℃时,在0.5 mol·L-1的醋酸溶液中由醋酸电离出的c(H+)约是由水电离出的c(H+)的_____倍。
(4)写出在NaCN溶液中通入少量CO2反应的离子方程式________________________。
(5)某兴趣小组为研究碳酸钠水解平衡与温度的关系,用数字实验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到曲线如图,下列分析合理的是___________。
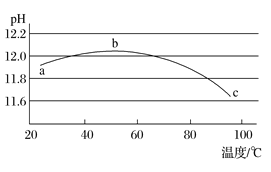
A 碳酸钠水解是吸热反应 B ab段说明水解平衡向右移动
C bc段说明水解平衡向左移动 D 水的电离平衡也对pH产生影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com