
| A、0.1mol?L-1CH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+ | ||||
B、Na2CO3溶液能使酚酞试液变红:CO
| ||||
C、铁溶于稀硝酸,溶液变黄:3Fe+8H++2NO
| ||||
| D、向Mg(OH)2悬浊液中加入FeCl3溶液,出现红褐色沉淀:3Mg(OH)2(s)+2Fe3+(aq)?2Fe(OH)3+Mg2+(aq) |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2010年四川绵阳高考预测(综合题)化学卷 题型:实验题
(16分)(Ⅰ)下列实验操作或实验叙述正确的是( )
A.可用过滤的方法除去氢氧化铁胶体中少量的氯化铁
B.用酸式滴定管量取18.80mL的碳酸钠溶液
C.配制0.1mol/L的硫酸时,用量筒量取浓硫酸,要洗涤量筒,否则配制的溶液浓度偏低
D.振荡用饱和的碳酸钠溶液吸收乙酸乙酯的试管,发现有气泡冒出,它是CO2气体
E.实验室制取氨气时,常用无水氯化钙进行干燥
(Ⅱ)红矾钠(重铬酸钠:Na2Cr2O2·2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作助剂,在化学工业和制药工业中用作氧化剂,应用十分广泛。
(1)实验室中红矾钠可用铬铁矿(主要成分:FeO·Cr2O3)作原料利用以下过程来制取。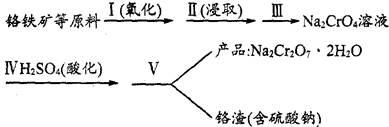
①步骤I中反应的化学方程式为:
4FeO·Cr2O3(s)+8Na2CO3(s)+7O2 8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
8Na2CrO4(s)+2Fe2O3(s)+8CO2,该反应的化学平衡常数的表达式为)_____________,在常温下该反应速率极慢,下列措施中不能使反应速率增大的是____________ 。
A、升高温度 B、将原料粉碎 C、增加纯碱的用量 D、通入过量的空气
②步骤Ⅱ中所得溶液显碱性,其中除含有Na2CrO4外,还含有铝、硅元素的化合物,它们的化学式可能是__________。
③步骤Ⅲ需将溶液的pH调至7~8并煮沸,其目的是_________________________________。
④步骤Ⅳ中发生反应的离子方程式为______________________________________________。
(2)将红矾钠与KCl固体按1:2(物质的量之比)混合溶于水后经适当操作可得到K2Cr2O7晶体。请填写表中空格,完成上述过程
| 序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
| ① | 溶解 | 将混合物放入烧杯中、加水、充分搅拌直到固体不能溶解 |
| ② | | |
| ③ | | |
| ④ | | |
| ⑤ | 过滤、干燥 | 得到K2Cr2O7晶体 |
查看答案和解析>>
科目:高中化学 来源:2012届重庆市高二下学期第一次月考化学试卷 题型:选择题
下列说法正确的是:
A.由于含K+的物质均易溶于水,所以离子方程式中不能出现K+
B.酸碱中和反应的离子方程式都可表示为:H+ +OH- =H2O
C.离子方程式两边的元素种类、原子个数、电荷数都相等时,该方程式一定正确
D.溶液中进行的反应:FeCl3
+3KSCN 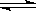 Fe(SCN)3
+3KCl达到平衡时,加入少量KCl晶体,平衡不移动
Fe(SCN)3
+3KCl达到平衡时,加入少量KCl晶体,平衡不移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com