
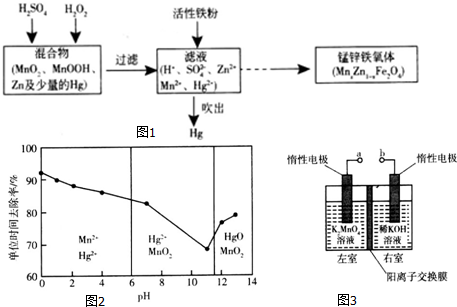
分析 Ⅰ、碱性锌锰电池的总反应是:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,正极MnO2得电子被还原生成MnOOH,反应式为2MnO2+2H2O+2e-═2MnOOH+2OH-;
Ⅱ、(1)在MnxZn1-xFe2O4中,Fe是+3价,O是-2价,Mn和Zn相当于1个原子;
(2)利用铁粉把Hg还原出来;
(3)①酸性高锰酸钾具有强氧化性,能够将Hg氧化;
②从影响化学反应速率的外界因素分析;
(4)电解K2MnO4制取KMnO4,阴极上水得电子发生还原反应生成氢气和氢氧根离子,阳极上锰酸根离子失电子反应氧化反应生成高锰酸根离子,据此分析.
解答 解:Ⅰ、碱性锌锰电池的总反应是:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,Zn为负极,Zn失电子生成锌离子,正极MnO2得电子被还原生成MnOOH,反应式为MnO2+H2O+e-═MnOOH+OH-,
故答案为:Zn;MnO2+e-+H2O=MnOOH+OH-;
Ⅱ、(1)在MnxZn1-xFe2O4中,Fe是+3价,O是-2价,Mn和Zn相当于1个原子,任何化合物中元素化合价代数和为0,所以Mn和Zn都是+2价,故答案为:+2;
(2)铁粉具有还原性,能把汞离子还原为汞单质,所以铁粉的作用是还原剂,故答案为:还原剂;
(3)①酸性高锰酸钾能够将Hg氧化为汞离子,本身被还原为锰离子,Mn化合价从+7降为+2价,Hg从0价升至+2价,其物质的量之比为5:2,结合原子守恒配平方程式为:5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O,故答案为:5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O;
②反应过程中,反应物浓度降低、温度不变、溶液中压强无影响,反应速率加快,只能是生成的Mn2+具有催化作用,故答案为:Mn2+具有催化作用;
(4)①阳极上锰酸根离子失电子反应氧化反应生成高锰酸根离子,所以a为正极,故答案为:正;
②据电极反应式2H2O+2e-=H2↑+2OH-可知,两室溶液的体积均为100mL,电解一段时间后,右室溶液的pH由10变为14,生成n(OH-)=1mol/L×0.1L=0.1mol,总反应方程式为2MnO42-+2H2O=2MnO4-+H2↑+2OH-,所以生成MnO42-物质的量为0.1mol,故答案为:0.1.
点评 本题考查了原电池原理、氧化还原反应的计算以及氧化还原反应方程式书写、影响反应速率的因素、电解池,题目难度较大.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:填空题
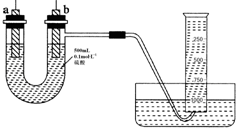 现有纯锌片、纯铜片和500mL 0.1mol•L-1的硫酸、导线、1 000mL量筒.用如下图所示装置利用原电池原理,制备一定量的氢气.
现有纯锌片、纯铜片和500mL 0.1mol•L-1的硫酸、导线、1 000mL量筒.用如下图所示装置利用原电池原理,制备一定量的氢气.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ Na+ OH- | B. | Na+ H+ SO32- | ||
| C. | K+ NO3- Cl- | D. | Ca2+ NO3- CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .从分液漏斗上口倒出的上层液体是苯.
.从分液漏斗上口倒出的上层液体是苯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
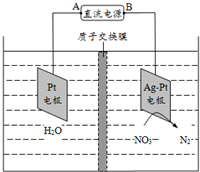
| A. | 电源的正极为b | |
| B. | 电解时H+从膜右侧迁移到膜左侧 | |
| C. | Ag-Pt电极反应为:2H2O-4e-=4H++O2↑ | |
| D. | 若转移的电子数为1.204×1024,生成N25.6 g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质失电子的反应为氧化反应 | |
| B. | 物质在变化中失去了电子,此物质是氧化剂 | |
| C. | 发生电子转移的反应即是氧化还原反应 | |
| D. | 发生化合价升降的反应不一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | VⅠA | VⅡA |
| 2 | a | b | c | ||||
| 3 | d | e | f | g | h | i |
| A. | a、b、e、f四种元素的原子半径:e>f>b>a | |
| B. | h、i两种元素阴离子的还原性:h>i | |
| C. | a、g两种元素氢化物的稳定性:g>a | |
| D. | d、e、f三种元素最高价氧化物对应的水化物的碱性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子是化学变化中的最小微粒 | |
| B. | 分子是化学变化中的最小微粒 | |
| C. | 原子是可分成更小粒子的实心球 | |
| D. | 原子是构成一切物质的基本粒子,是构成物质的最小粒子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com