
| A. | 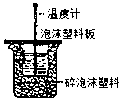 测定酸碱反应中和热 | B. | 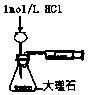 测定反应速率 | ||
| C. | 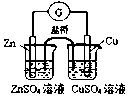 实现化学能转换为电能 | D. | 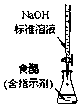 测定食醋浓度 |
科目:高中化学 来源: 题型:选择题
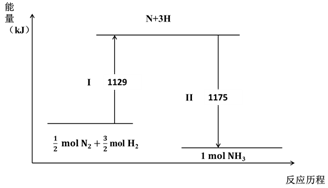
| A. | Ⅰ过程中破坏的均为非极性键 | |
| B. | Ⅰ过程吸收能量,II过程放出能量 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H=-44 kJ•mol-1 | |
| D. | 1mol N2(g)与3 mol H2(g)所具有的总能量比2 mol NH3(g) 所具有的总能量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 置换反应 | B. | 复分解反应 | C. | 分解反应 | D. | 化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
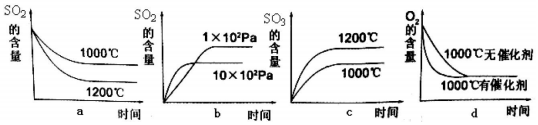
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:Cr3+>SO2 | |
| B. | 方程式②中,a=6,b=7 | |
| C. | Cr2O72-能将Na2SO3 氧化成 Na2SO4 | |
| D. | 方程式①中 W 为 OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:E>D>C>B>A | |
| B. | B、C、D与A形成的化合物中,D的化合物沸点一定最高 | |
| C. | A与B、C、D、E形成的化合物中A的化合价均为+1价 | |
| D. | A、B、C、D四种元素形成的某种离子化合物与酸和碱反应都可能放出气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 符合的条件 | 物质的代号 |
| 混合物 | |
| 可以导电的物质 | |
| 非电解质 | |
| 既不是电解质,也不是非电解质 | |
| 强电解质 | |
| 弱电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com