
| A. | 任何温度下反应均难以自发进行 | B. | 任何温度下反应均可以自发进行 | ||
| C. | 仅常温下反应可以自发进行 | D. | 仅高温下反应可以自发进行 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
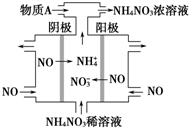 2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策.科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有:
2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策.科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4=Na2++SO42- | B. | MgCl2=Mg2++Cl- | ||
| C. | HNO3=H++3NO- | D. | Ba(OH)2=Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
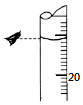 某同学欲用物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂.请填写下列空白:
某同学欲用物质的量浓度为0.100 0mol•L-1的盐酸测定未知物质的量浓度的氢氧化钠溶液,选择酚酞作指示剂.请填写下列空白:| 滴定 次数 | 待测溶液 体积/mL | 标准酸体积 | |
| 滴定前的刻度/mL | 滴定后的刻度/mL | ||
| 第一次 | 10.00 | 1.34 | 19.39 |
| 第二次 | 10.00 | 4.10 | 21.10 |
| 第三次 | 10.00 | 0.40 | 17.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++SO2+2H2O═SO42-+4H++2Fe2+ | B. | 2Br-+SO42-+4H+═SO2+Br2+2H2O | ||
| C. | 2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | D. | 2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠用于治疗胃酸过多 | |
| B. | 阿司匹林常用于解热镇痛 | |
| C. | 青霉素是一种常用的抗生素,使用前没有必要进行皮肤敏感实验 | |
| D. | 非处方药都无毒副作用,可长期大量服用 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com