
 甲溶液中含Aa+离子浓度为0.10mol/L,乙溶液含Bb-离子浓度为0.35mol/L,取不同体积甲、乙两溶液的物质的量如图所示.则沉淀物的化学式为( )
甲溶液中含Aa+离子浓度为0.10mol/L,乙溶液含Bb-离子浓度为0.35mol/L,取不同体积甲、乙两溶液的物质的量如图所示.则沉淀物的化学式为( )| A. | A2B3 | B. | A3B2 | C. | AB2 | D. | A2 |
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:解答题
| 实验步骤 | 操作方法 | 实验现象 | 结论或解释 |
| 1 | 观察氯水的颜色 | 含有Cl2 | |
| 2 | 有无色气体产生 | 含有H+ | |
| 3 | 取少量氯水于试管中,加入稀硝酸酸化的硝酸银溶液 | 有白色沉淀生成 | |
| 4 | 取少量氯水于试管中,放入红色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
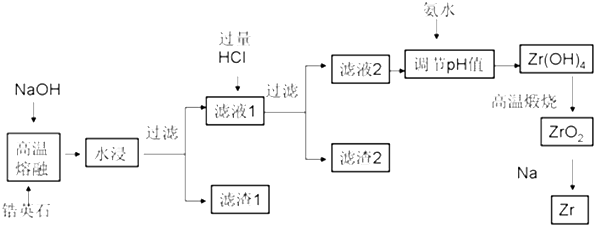
| 沉淀物 | Zr(OH)4 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时pH | 1.2 | 2.7 | 3.4 | 6.3 |
| 完全沉淀时pH | 2.4 | 3.2 | 5.2 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溶质物质的量之比为 2:7 的三氯化铝溶液和氢氧化钡溶液混合:2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | 澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 向硫酸氢钠溶液中滴加 Ba(OH)2 至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | 敞开体系,向FeCl2 溶液滴加NaOH 溶液:4Fe2++8OH-+O2+2H2O═4Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

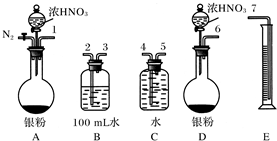
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
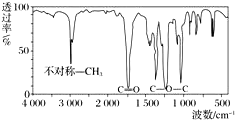 取8.8g有机物X,完全燃烧后只生成7.2g水和 8.96L CO2(标准状况),已知该有机物的蒸气对氢气的相对密度为44,其红外光谱图如图.关于X的说法错误的是( )
取8.8g有机物X,完全燃烧后只生成7.2g水和 8.96L CO2(标准状况),已知该有机物的蒸气对氢气的相对密度为44,其红外光谱图如图.关于X的说法错误的是( )| A. | 其化学式为C4H8O2 | |
| B. | 其满足右侧图象的酯有3种 | |
| C. | 鉴定该有机物的结构可用红外光谱或核磁共振氢谱 | |
| D. | 若结构为CH3COOCH2CH3,其核磁共振氢谱中有3个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①② | C. | ①③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe( NO3)3溶液中加入过量HI溶液:2Fe3++2I-═2Fe2++I2 | |
| B. | 浓烧碱溶液中加入铝片:2A1+2OH-═2AlO2-+H2 | |
| C. | H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4+H2O | |
| D. | 将新制氢氧化铜悬浊液加入氨水中:Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com