
某温度下,容积同为2L的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
(已知某温度下2HI(g)  H2 (g)+I2 (g) ΔH =+AkJ·mol-1 K=4.0)
H2 (g)+I2 (g) ΔH =+AkJ·mol-1 K=4.0)
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 2 mol HI | 1 mol H2+1 mol I2 | 2 mol HI+1 mol H2 +1 mol I2 |
HI的浓度 | c1 | c2 | c3 |
反应的能量变化 | 吸收akJ | 放出bkJ | 吸收ckJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | a1 | a2 | a3 |
(1)根据上表回答问题
①c1、c3的关系式为 ;②a、b的关系式为 ;
③p2、p3的关系式为 ;④a1与a2的关系式为 ;
(2)甲容器中:该反应的平衡常数表达式为 。
(3)乙容器中:反应在开始2分钟后达平衡状态,则该反应在这2分钟内用HI表示的平均反应速率为 mol·L ·min
·min
(4)丙容器中:反应开始时V正 V逆(填“小于”、“等于”或“大于”)
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案科目:高中化学 来源:2015-2016学年上海市高二上学期期中测试化学试卷(解析版) 题型:选择题
下列说法中,正确的是
A.第ⅠA族元素都是金属元素
B.第ⅣA族非金属元素的单质只能形成原子晶体
C.第ⅥA族元素形成的单质,常温下有气、液、固三种状态
D.元素性质呈现周期性变化的根本原因是元素原子最外层电子数呈现周期性变化
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江台州中学高二上第三次统练化学试卷(解析版) 题型:选择题
下列叙述中说明某化学平衡一定发生移动的是
A.混合物中各组分的浓度改变
B.混合体系中气体密度发生变化
C.正、逆反应速率改变
D.反应物的转化率改变
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南常德市高二12月月考化学卷(解析版) 题型:选择题
已知①C(s)+H2O(g)=CO(g)+H2(g) △H=a kJ/mol,②2C(s)+O2(g)=2CO(g) △H=-220 kJ/mol H-H、O=O和O-H键的键能分别为436、496和462 kJ/mol,则a为()
A.-332 B.-118 C.+350 D.+130
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江齐齐哈尔实验中学高一上期中化学卷(解析版) 题型:选择题
常温下,发生下列几种反应:①16H++10Z-+2 XO4-==2X2++5Z2+8H2O ②2A2++B2===2A3++2B- ③2B-+Z2===B2+2Z- 根据上述反应,判断下列结论错误的是( )
A.溶液中可发生:Z2+2A2+===2A3++2Z-
B.Z2在①③反应中为还原剂
C.氧化性强弱的顺序为XO4->Z2>B2>A3+
D.X2+是XO4-的还原产物
查看答案和解析>>
科目:高中化学 来源:2016届河北邯郸第一中学高三一轮收官考试一理综化学卷(解析版) 题型:简答题
【化学-物物质结构与性质】原子序教依次增大的四种元素A、B、C、D分别处于第一至第四周期.自然界中存在多种A的化合物,B 原子核外电子有6 种不同的运动状态,B 与C可形成正四面体形分子.D 的基态原子的最外能层只有一个电子.其他能层均己充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素.其基态原子的价电子排布图为_________.第一电离能最小的元素是______(填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是_________(填化学式),呈现如此递变规律的原因是___________________。
(3)B元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为______、另一种的晶胞如图二所示,若此晶胞中的棱长为356.6pm,则此晶胞的密度为______g•cm-3 (保留两位有效数字).( )
)

(4)D元素形成的单质,其晶体的堆积模型为_________,D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是_______(填选项序号).
①极性键 ②非极性键 ③配位键 ④金属键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江余姚中学高二上学期期中考试化学试卷(解析版) 题型:填空题
过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态.如图I是1molNO2与1molCO恰好反应生成CO2和NO过程中的能量变化示意图。
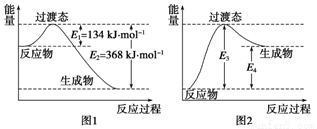
(1)试写出NO2 和CO反应的热化学方程式:____.该反应的活化能是___kJ·mol-1
(2) 图2 是某学生模仿图l画出的NO(g)+CO2(g)= NO2(g)十CO(g)的能量变化示意图。则图中E3=_kJ·mol-1,E4=____ kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东枣庄三中高二10月学情调查化学卷(解析版) 题型:选择题
某原电池装置如图所示,电池总反应为2Ag + Cl2=2 AgCl。下列说法正确的是
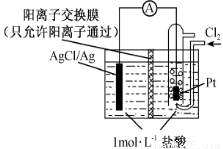
A.正极反应AgCl +e- = Ag+Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东湛江第一中学高二上第二次考试化学卷(解析版) 题型:填空题
某一元弱酸(用HA表示)在水中的电离方程式是:HA H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体, 以上平衡将向________(填“正”、“逆”)反应方向移动,理由是 。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向______(填“正”、“逆”)反应方向移动,溶液中c(A-)将________(填“增大”、“减小”或“不变”),溶液中c(OH-)将________(填“增大”、“减小”或“不变”)。
(3)在25 ℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_______性(填“酸”、“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com