



 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题

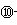 号元素的核外电子排布式_______________________________________;
号元素的核外电子排布式_______________________________________;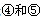 第一电离能的大小关系为________________(用元素符号表示)
第一电离能的大小关系为________________(用元素符号表示)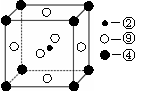
| A.分子中含有氢键 | B.易发生加成反应 |
| C.含有4个σ键和1个π键 | D.分子中所有原子处于同一个平面 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 序号 | 元素 | 结构及性质 |
| ① | A | A在第三周期中简单离子半径最小 |
| ② | B | B原子最外层电子数是内层电子数的1/5 |
| ③ | C | C是常用化肥的主要元素,单质常温下呈气态 |
| ④ | D | 通常情况下,D没有正化合价,A、B、C都能与D形成化合物 |
| ⑤ | E | E在周期表中可以排在IA族,也可以排在ⅦA族 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2O是一种非常稳定的化合物,这是由于氢键所致 |
| B.稀有气体形成的晶体属于分子晶体 |
| C.干冰升华时,分子内共价键会发生断裂 |
| D.金属晶体的熔点普遍都很高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com