
| A. | 纤维素、油脂、蛋白质均是天然高分子化合物 | |
| B. | 聚氯乙烯塑料制品可用于食品包装 | |
| C. | “地沟油”可以食用,也可以用来制肥皂 | |
| D. | 利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程 |
分析 A.相对分子质量在10000以上的有机化合物为高分子化合物;
B.聚氯乙烯塑料中的增塑剂有毒;
C.地沟油对人体健康有害,可作为工业原料;
D.有新物质生成的是化学变化.
解答 解:A.纤维素的基本结构单元是葡萄糖单元,为天然高分子化合物,蛋白质是由氨基酸缩聚形成的高分子化合物,油脂是高级脂肪酸与甘油形成的酯,相对分子质量不大,不属于高分子化合物,故A错误;
B.聚氯乙烯塑料中的增塑剂有毒,不能用于包装食品,故B错误;
C.地沟油对人体健康有害,可作为工业原料,属于酯类物质,可用于制取肥皂、汽油、柴油等,故C错误;
D.用粮食酿酒时,先在糖化酶作用下水解为葡萄糖,然后在酵母作用下转变为酒精,都是化学变化,故D正确.
故选D.
点评 本题考查较为综合,侧重于化学与生活、生产的考查,有利于培养学生的良好的科学素养,提高学生学习的积极性,题目难度不大,注意相关基础知识的积累.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑥ | B. | ②④⑥⑦ | C. | ②⑤⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B的质量数.B原子核内质子数和中子数相等.下面叙述中不正确的是( )
如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B的质量数.B原子核内质子数和中子数相等.下面叙述中不正确的是( )| A. | 三种元素的原子半径的大小顺序是B<A<C | |
| B. | A元素最高价氧化物对应水化物具有强氧化性和不稳定性 | |
| C. | B元素的氧化物和氢化物的水溶液都呈酸性 | |
| D. | C元素的单质是非金属单质中唯一能跟水激烈反应的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
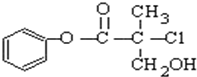
| A. | l mo1 A和足量的H2发生加成反应,最多可以消耗3 mol H2 | |
| B. | 有机物A可以和Br2的CCl4溶液发生加成反应 | |
| C. | 有机物A和浓硫酸混合加热,可以发生消去反应 | |
| D. | l mo1 A和足量的NaOH溶液反应,最多可以消耗3 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质常用作半导体材料和光导纤 | B. | 在自然界中以化合态的形式存在 | ||
| C. | 最高价氧化物不与任何酸反应 | D. | 气态氢化物比甲烷稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知草酸氢钾溶液呈酸性,则在amol•L-1 KHC2O4溶液中,c(C2O42-)<c(H2C2O4) | |
| B. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| C. | 0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 | |
| 起始反应物投入量 | 2mol H2、l mol CO | 1mol CH3OH | 2mol CH3OH | |
| 平 | c(CH,0H)/mol/L | C1 | C2 | c3 |
| 衡 | 反应的能量变化ZkJ | x | y | z |
| 数 | 体系压强/Pa | P1 | P2 | P3 |
| 据 | 反应物转化率 | a1 | a2 | a3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com