
| A. | 流程中涉及的反应均为非氧化还原反应 | |
| B. | 反应②产生的阴离子主要为CO32- | |
| C. | 实验室中完成反应③应在蒸发皿中进行 | |
| D. | 反应①中发生的主要反应为:Al2O3+2OH-=2AlO2-+H2O |
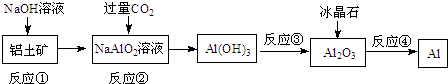
分析 由实验流程可知,①中铝土矿中氧化铝与NaOH发生反应生成偏铝酸钠和水,②通入过量CO2发生反应CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓,过滤后氢氧化铝分解生成氧化铝,最后电解氧化铝生成Al,以此来解答.
解答 解:由实验流程可知,①中铝土矿中氧化铝与NaOH发生反应生成偏铝酸钠和水,②通入过量CO2发生反应CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓,过滤后氢氧化铝分解生成氧化铝,最后电解氧化铝生成Al,
A.电解熔融Al2O3的反应属于氧化还原反应,反应的方程式为2Al2O3(熔融)$\frac{\underline{\;冰晶石\;}}{电解}$4Al+3O2↑,属于氧化还原反应,故A错误;
B.②通入过量CO2发生反应CO2+2H2O+AlO2-═HCO3-+Al(OH)3↓,阴离子主要为HCO3-,故B错误;
C.反应③为加热分解氢氧化铝固体应在坩埚中进行,故C错误;
D.①中铝土矿中氧化铝与NaOH发生反应生成偏铝酸钠和水,离子方程式为Al2O3+2OH-=2AlO2-+H2O,故D正确.
故选D.
点评 本题考查物质的分离、提纯,为高频考点,侧重于学生的分析、实验能力的考查,注意把握流程中的反应、物质的性质的异同及混合物分离方法,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
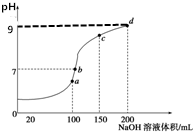 室温时,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH值与NaOH溶液体积的关系曲线如图所示(忽略溶液混合时的体积变化),下列判断不正确的是( )
室温时,向100mL0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液,得到的溶液pH值与NaOH溶液体积的关系曲线如图所示(忽略溶液混合时的体积变化),下列判断不正确的是( )| A. | a点所示的溶液中:c(Na+)=c(SO42-)>c(NH4+) | |
| B. | b点所示的溶液中:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) | |
| C. | c点所示的溶液中:c(Na+)+c(NH4+)=2c(SO42-) | |
| D. | d点所示的溶液中:c(NH4+)+10-9mol•L-1=$\frac{{K}_{w}}{1{0}^{-9}}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制各铝的工艺流程:
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如图是从铝土矿中制各铝的工艺流程:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 ( 25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | 向NaCN溶液中通入少量的CO2发生的离子反应为:2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN) | |
| C. | 中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者 | |
| D. | 等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往溶液中加入适量的氢氧化钠,使溶液中c(Na+)=c(CH3 COO-) | |
| B. | 将溶液与10 mLpH=10的NaOH溶液混合 | |
| C. | 将溶液与10 mL浓度为a mol•L-1的NaOH溶液混合 | |
| D. | 将溶液稀释到10 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,取浓度均为0.01mol•L-1的HA溶液和MOH溶液各20mL,分别用0.01mol•L-1NaOH溶液、0.01mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
常温下,取浓度均为0.01mol•L-1的HA溶液和MOH溶液各20mL,分别用0.01mol•L-1NaOH溶液、0.01mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )| A. | HA和MOH均为弱电解质 | |
| B. | 曲线a中,滴加溶液到20mL时,c(Cl-)=c(M+)=c(OH-)=c(H+) | |
| C. | 曲线b中,滴加溶液到20mL时,c(Na+)>c(A-)>c(OH-)>c(H+) | |
| D. | 曲线b中,滴加溶液到10mL时,c(A-)+c(OH-)=c(H+)+c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com