
分析 钙、碳的质量分数分别为50%、l5%,则氮的质量分数为35%,可知n(Ca):n(C):n(N)=$\frac{50%}{40}$:$\frac{15%}{12}$:$\frac{35%}{14}$=1:1:2,则分子式为CaCN2,
石灰氮完全水解的产物是A和B,其中B是制取氮肥的主要原料,因N为-3价,则水解生成碳酸钙和氨气,即A为CaCO3,B为NH3;
A在高温下分解生成C和D,通常状况下,C为气体,应为CO2,D为CaO;
B的催化氧化产物为E和F,应分别为NO和H2O;
F继续氧化后的产物G遇到E生成一种工业强酸,判断F为NO,G为NO2,E为H2O;
将G为NO2和F为NO的混合物溶解在接近零度的水中,即生成亚硝酸的水溶液,该反应可表示如下G+F+H2O=2HNO2(已配平),化学方程式为NO2+NO+H2O=2HNO2;依据推断分析回答,
(1)石灰氮的化学式CaCN2;
(2)足量B和C与饱和氯化钠溶液反应生成碳酸氢钠和氯化铵;
(3)在酸性条件下,当NaNO2与KI按物质的量1:1恰好完全反应,且I-被氧化为I2时,结合电子守恒分析氮元素被还原产物;在酸性条件下会发生化学反应,如果通入二氧化硫,会被亚硝酸氧化为硫酸,即二氧化硫具有还原性,亚硝酸具有氧化性导致,次氯酸具有强氧化性能氧化亚硝酸钠;
(4)亚硝酸钠具有氧化性,金属铝只有还原性,发生的反应是亚硝酸钠和金属铝之间的反应,即Al+NaNO2+NaOH=NH3•H2O+NaAlO2,铝元素化合价从0价升高到+3价,若改用电解法将废水中NO2-转换为N2除去需要发生还原反应得到电子,电解池中阴极反应还原反应;
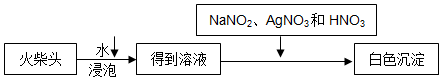
(5)亚硝酸根离子具有还原性,能还原氯酸根离子生成氯离子,氯离子和酸性硝酸银溶液反应生成不溶于稀硝酸的白色沉淀;
(6)要确定火柴头中含KClO3,还需进行的实验操作是检验钾离子的存在,可以利用焰色反应设计实验验证;
解答 解:钙、碳的质量分数分别为50%、l5%,则氮的质量分数为35%,可知n(Ca):n(C):n(N)=$\frac{50%}{40}$:$\frac{15%}{12}$:$\frac{35%}{14}$=1:1:2,则分子式为CaCN2,
石灰氮完全水解的产物是A和B,其中B是制取氮肥的主要原料,因N为-3价,则水解生成碳酸钙和氨气,即A为CaCO3,B为NH3;
A在高温下分解生成C和D,通常状况下,C为气体,应为CO2,D为CaO;
B的催化氧化产物为E和F,应分别为NO和H2O;
F继续氧化后的产物G遇到E生成一种工业强酸,判断F为NO,G为NO2,E为H2O;
将G为NO2和F为NO的混合物溶解在接近零度的水中,即生成亚硝酸的水溶液,该反应可表示如下G+F+H2O=2HNO2(已配平),化学方程式为NO2+NO+H2O=2HNO2;
(1)钙、碳的质量分数分别为50%、l5%,则氮的质量分数为35%,可知n(Ca):n(C):n(N)=$\frac{50%}{40}$:$\frac{15%}{12}$:$\frac{35%}{14}$=1:1:2,则分子式为CaCN2,
故答案为:CaCN2 ;
(2)足量B为NH3,C为CO2,与饱和氯化钠溶液的反应是化工生产中生产某种重要化工产品的重要反应,是侯德榜制碱,反应化学方程式为:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl;
故答案为:NaCl+NH3+H2O+CO2=NaHCO3↓+NH4Cl;
(3)碘离子被氧化为碘单质时,所有的碘元素化合价升高了2价,消耗碘离子是2mol,亚硝酸钠中氮元素化合价是+3价,2mol的亚硝酸钠得到2mol电子时,
则需氮元素的化合价降为+2价,所以产物中含氮的物质为NO;浓NaNO2溶液中通入二氧化碳,会发生反应生成碳酸钠,在酸性条件下会发生化学反应,如果通入二氧化硫,会被亚硝酸氧化为硫酸,即二氧化硫具有还原性,亚硝酸具有氧化性导致,次氯酸具有强氧化性能氧化亚硝酸钠;
故答案为:NO; b d e;
(4)亚硝酸钠具有氧化性,金属铝只有还原性,发生的反应是亚硝酸钠和金属铝之间的反应,即Al+NaNO2+NaOH=NH3•H2O+NaAlO2,铝元素化合价从0价升高到+3价,反应的离子方程式为:2Al+NO2-+OH-+H2O=2AlO2-+NH3↑,若改用电解法将废水中NO2-转换为N2除去需要发生还原反应得到电子,电解池中在阴极得到电子生成氮气,
故答案为:2Al+NO2-+OH-+H2O=2AlO2-+NH3↑;阴极;
(5)KClO3具有强氧化性,亚硝酸钠具有还原性,二者能发生氧化还原反应生成氯离子,氯离子和硝酸银溶液反应生成不溶于稀硝酸的氯化银白色沉淀,离子反应方程式为:ClO3-+3NO2-+Ag+=AgCl↓+3NO3-,
故答案为:ClO3-+3NO2-+Ag+=AgCl↓+3NO3-;
(6)在(5)方案基础上,要确定火柴头中含KClO3,还需进行的实验操作为:进行焰色反应,透过蓝色钴玻璃观察,若火焰呈紫色,则说明火柴头中含有KClO3,
故答案为:进行焰色反应,透过蓝色钴玻璃观察,若火焰呈紫色,则说明火柴头中含有KClO3;
点评 本题考通过探究物质的组成,考查了物质性质实验方案的设计,题目难度中等,正确分析题干信息明确实验原理为解答关键,试题侧重考查学生的分析、理解能力及灵活应用所学知识的能力,是一道质量较好的题目.


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电子式表示溴化氢的形成过程为: | |
| B. | SO2使溴水褪色,显示了SO2的还原性 | |
| C. | 从溴水中提取单质溴,可以用乙醇进行萃取 | |
| D. | SO2是形成酸雨的唯一原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H6和C4H8互为同系物 | |
| B. | 苯乙烯分子中的所有原子不可能处于同一个平面 | |
| C. | CH2Cl2有2种同分异构体 | |
| D. | 乙酸与乙醇的酯化反应是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 饱和食盐水中先通入的气体为CO2 | |
| B. | 流程图1中的“系列操作”中一定需要玻璃棒 | |
| C. | 如图2所示装置可以比较Na2CO3和NaHCO3晶体的热稳定性 | |
| D. | 对粗盐溶液除杂可依次加入过量NaOH、Na2CO3、BaCl2 溶液,过滤后再加入盐酸调节溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn与稀H2SO4反应:2Zn+2H+=2Zn2++H2↑ | |
| B. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+ | |
| C. | 碳酸氢铵溶液与足量澄清石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 固体碳酸钙中滴加足量盐酸:CaCO3+2H+=Ca2++CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com