



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Cu2+��NO3-��Fe2+��Cl- |
| B��Fe3+��SO42-��Mg2+��OH- |
| C��Na+��SO32-��NO3-��H+ |
| D��HCO3-��NH4+��H+��Na+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
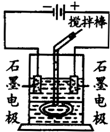 �ڲ���ԲͲ��ʢ��������ɫ�Ļ������ܵ�����Һ�壮�ϲ�Һ���в�������ʯī�缫��ԲͲ�ڻ�����һ���¶���ɻ�״�IJ�����������������½���Һ�壬װ����ͼ����ͨ��Դ��������Χ��Һ�������ɫ������ɫ��dz������������������ɣ�ֹͣͨ�磬ȡ���缫���ý�������¾��ҽ��������ú�Һ���ֳַ����㣬�²�Һ����Ϻ�ɫ���ϲ�Һ�弸����ɫ��
�ڲ���ԲͲ��ʢ��������ɫ�Ļ������ܵ�����Һ�壮�ϲ�Һ���в�������ʯī�缫��ԲͲ�ڻ�����һ���¶���ɻ�״�IJ�����������������½���Һ�壬װ����ͼ����ͨ��Դ��������Χ��Һ�������ɫ������ɫ��dz������������������ɣ�ֹͣͨ�磬ȡ���缫���ý�������¾��ҽ��������ú�Һ���ֳַ����㣬�²�Һ����Ϻ�ɫ���ϲ�Һ�弸����ɫ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
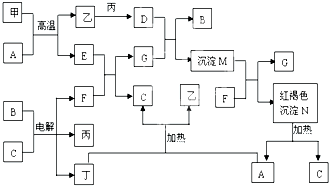 ��ͼΪ��ѧ�������ʼ��ת����ϵ�����мס��ҡ�������Ϊ���ʣ�����Ϊ�������������Ԫ������������������������C������Ϊ��ɫҺ�壬B��ɫ��ӦΪ��ɫ��һЩ����Һ�н��еķ�Ӧ��Һ�е�H2O�����ɵ�H2O��ʡ�ԣ��ش��������⣺
��ͼΪ��ѧ�������ʼ��ת����ϵ�����мס��ҡ�������Ϊ���ʣ�����Ϊ�������������Ԫ������������������������C������Ϊ��ɫҺ�壬B��ɫ��ӦΪ��ɫ��һЩ����Һ�н��еķ�Ӧ��Һ�е�H2O�����ɵ�H2O��ʡ�ԣ��ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| c(H+) |
| c(OH-) |
| c(H+) |
| c(HA) |
| c(HA) |
| c(A-) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����³�ѹ�£�11.2L CH4����C-H����ĿΪ2NA |
| B��������Fe��1molCl2��Ӧ����ת����Ϊ3NA |
| C��32g O2��O3������Oԭ����Ŀ��Ϊ2NA��M��O��=16g/mol�� |
| D����״���£�22.4L�ļ�ϩ�к��еķ�����ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� |
| B��H2N��CH2��5COOH |
| C��HO��CH2��5COOH��HO��CH2��5NH2 |
| D��HOOC��CH2��4COOH��H2N��CH2��5NH2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com