
| A. | 22.4 L氧气中,一定含有2mol氧原子 | |
| B. | 80 g NaOH溶解在1 L水中,得到溶液的物质的量浓度为2mol/L | |
| C. | 18 g水在标准状况下的体积约为22.4L | |
| D. | 标准状况下,20 mLNH3跟60 mLO2所含分子个数比为1:3 |
分析 A.根据影响气体体积的因素进行分析;
B.80gNaOH的物质的量=$\frac{80g}{40g/mol}$=2mol,根据C=$\frac{n}{V}$判断;
C.标况下,气体摩尔体积适用于气体,不适用于液体和固体;
D.相同条件下,气体体积之比等于其分子数目之比.
解答 解:A.气体的体积受温度、压强、物质的量影响,没有告诉条件,无法计算22.4 L氧气的物质的量,故A错误;
B.80gNaOH的物质的量=$\frac{80g}{40g/mol}$=2mol,根据C=$\frac{n}{V}$知,V溶液体积不是溶剂体积,80gNaOH溶于1L水中溶液的体积大于1L,所以氢氧化钠的物质的量浓度小于2mol/L,故B错误;
C.标况下,气体摩尔体积适用于气体,不适用于液体和固体,水是液体,气体摩尔体积对其不适用,故C错误;
D.同温同压下,气体体积之比等于其分子数目之比,故标准状况时,20mLNH3与60mL O2所含的分子个数比=20mL:30mL=1:3,故D正确;
故选D.
点评 本题考查了物质的量有关计算,明确基本公式中各个物理量的含义是解本题关键,注意气体摩尔体积的适用范围及适用条件分析解答,易错选项是BV溶液体积不是溶剂体积,本题难度不大.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
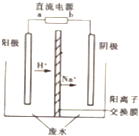 用甲烷、甲醇、乙醇、甲醚等可以制成燃料电池.实验室中,若以甲醇燃料电池为直流电源,以一定浓度的乙醛和 Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其原理是乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,其装置示意图如图所示.
用甲烷、甲醇、乙醇、甲醚等可以制成燃料电池.实验室中,若以甲醇燃料电池为直流电源,以一定浓度的乙醛和 Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其原理是乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,其装置示意图如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
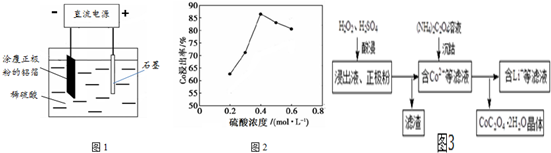
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(A)=0.6 mol/(L•s) | B. | V(B)=0.9 mol/(L•s) | C. | V(C)=0.4 mol/(L•s) | D. | V(D)=1.0 mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
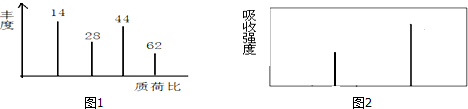
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com