
| A. | 元素X有三种同位素 | |
| B. | 其中一种同位素质量数为36 | |
| C. | 质量数为35的同位素原子的质量分数为75% | |
| D. | 元素单质X2的平均式量为71 |
分析 A.依据双原子单质分子有三种,确定该元素存在两种同位素;
B.依据两种同位素形成的三种单质的式量分析两种同位素的质量数为35、37;
C.根据三种单质的物质的量之比为9:6:1进行计算;
D.根据三种单质的物质的量之比为9:6:1,结合平均式量=$\frac{总质量}{总物质的量}$进行计算.
解答 解:A.元素构成的双原子单质分子有三种,其式量分别为70、72、74,推断该元素存在两种同位素,若是三种同位素则形成的单质应为6种,故A错误;
B.根据双原子单质分子有三种,其式量分别为70、72、74可知,最大的式量为37X2,最小式量为35X2,所以质量数不可能为36,故B错误;
C.元素构成的双原子单质分子有三种,其式量分别为70、72、74,此三种单质的物质的量之比为9:6:1,故质量数为35的同位素原子的质量分数为$\frac{9×2+6}{(9+6+1)×2}×100%$=75%,故C正确;
D.平均式量=$\frac{总质量}{总物质的量}$=$\frac{70×9+72×6+74×1}{9+6+1}$=71,故D正确;
故选CD.
点评 本题考查元素同位素的综合应用,依据同位素为载体考查质量数的确定和计算,平均式量的计算方法,难度中等.正确理解同位素的概念和特征应用是解题的关键.


科目:高中化学 来源: 题型:解答题
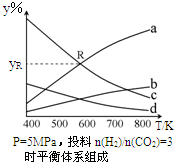 以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=QkJ/mol (Q>0)在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所示.
以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)△H=QkJ/mol (Q>0)在密闭容器中,按CO2与H2的物质的量之比为1:3进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应KIO3+6HI=KI+3H2O+3I2,生成3mol I2转移电子的总数为6NA | |
| B. | 标准状况下,由0.4 mol H2O2生成O2转移的电子数目为0.2NA | |
| C. | 12g石墨和C60的混合物中质子总数为6NA | |
| D. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、NH4+、CH3COOH、S2-可以大量共存 | |
| B. | 和碘水反应的离子方程式:SO32-+I2+H2O=SO42-+2I-+2H+ | |
| C. | 和足量氢氧化钡溶液反应的离子方程式:HSO3-+Ba2++OH-=BaSO3↓+H2O | |
| D. | 1L该溶液和足量稀硝酸充分反应,生成标状况下2.24LSO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
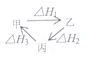
| A. | 甲、乙、丙三物质转化如图所示,则△H1=△H2+△H3 | |
| B. | 1molCO完全燃烧生成稳定氧化物放出热量为283.0KJ,则2 CO2(g)=2 CO(g)+O2(g),△H=+566.0KJ•mol-1 | |
| C. | 若N2(g)+3H2(g)?2NH3(g),△H=-92.4KJ•mol-1,故在某容器中充入1mol N2与3molH2充分反应后,放出的热量为92.4KJ | |
| D. | 常温下,稀HCl和稀NaOH溶液反应生成1molH2O放出热量为57.3 KJ,其热化学方程式为HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(aq),△H=-57.3KJ |
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第13次周测理科综合化学试卷 题型:推断题
[化学——选修5:有机化学基础]抗疟新药青蒿素的结构简式如下图所示。
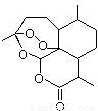
(1)青蒿素的分子式为____。
(2)为了引入过氧基(-O-O-),需要在有机合成中引入羟基,引入羟基的反应类型有____。(选填编号)
①取代反应 ②加成反应 ③消去反应 ④酯化反应 ⑤还原反应
天然香草醛(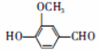 )可用于合成青蒿素,合成天然香草醛的反应如图:
)可用于合成青蒿素,合成天然香草醛的反应如图:
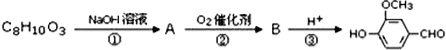
(3)M的结构简式为____。
(4)步骤①③的作用是____。
(5)C与这种天然香草醛互为同分异构体,写出符合下列条件的C的结构简式____。
①苯环二取代;②能水解;③能发生银镜反应;④与FeCl3溶液发生显色反应。
(6)苄基乙醛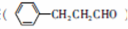 是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应:
是合成青蒿素的中间原料之一,写出由苯甲醛和氯乙烷为原料,制备苄基乙醛的合成路线流程图(无机试剂任用)。已知:羰基α-H可发生反应:
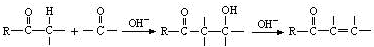
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第13次周测理科综合化学试卷 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与Y同主族。下列说法正确的是
A. Z元素的简单离子是其所在周期中元素的简单离子半径最小的
B. Y的简单气态氢化物的热稳定性比W的强
C. Y与W形成的化合物一定能使酸性高锰酸钾溶液褪色
D. 最高价氧化物对应水化物的酸性X比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3溶液:c(OH-)=c(HSO3-)+c(H+)+c(H2SO3) | |
| B. | CuSO4•(NH4)2SO4•6H2O的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>C(OH-) | |
| C. | 氯气溶于水达到平衡后,若其他条件不变加入CaCO3固体,$\frac{c({H}^{+})}{c(HClO)}$增加 | |
| D. | NaSiO3溶液加水稀释后,恢复至原温度,pH和KW均减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com