
����Ŀ�����÷ϱ���(��Ҫ�ɷ�ΪBaS2O3��������SiO2)Ϊԭ�������ߴ�������������������
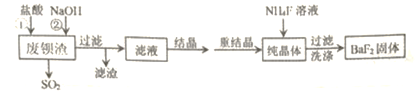
��֪��Ksp(BaS2O3)=6.96��10-11��Ksp(BaF2)=1.0��10-6
��1����������ʱ������SO2�⣬���е���ɫ�������ɡ��÷�Ӧ�����ӷ���ʽΪ____________��
��2����Һ����Ҫ�ɷ���_____________��(�ѧʽ)
��3����ҵ�Ͽ��ð�ˮ����SO2����ͨ�����ʹ��ת��Ϊ��̬���ʡ���ת�����������뻹ԭ�������ʵ���֮��Ϊ_______________��
��4������NaOH��Һ��Ŀ�����к����������������˹�������ԭ����_____________(�����ӷ�Ӧ����ʽ��ʾ)��
��5������BaF2�ķ�Ӧ�Ļ�ѧ����ʽΪ______________��
�����÷�Ӧ�¶ȹ��ߣ��������c(F-)���͵�ԭ����___________________��
���о��������ʵ�����NH4F�ı������������BaF2�IJ��ʺʹ��ȡ���Ũ��Ϊ0.1mol��L-1��BaCl2��Һ��0.22 mol��L-1NH4F��Һ�������ϣ�������Һ��c(Ba2+)=______mol��L-1��
���𰸡� BaS2O3+2H+=Ba2++S��+SO2��+ H2O BaCl2��NaCl 1��2 2OH-+SiO2=SiO32-+H2O BaCl2+2NH4F=BaF2��+2NH4Cl �¶Ƚϸߴٽ�F-ˮ�⣬ʹc(F-)���� 0.01
��������������Ҫ������������÷ϱ���Ϊԭ�������ߴ��������������������ۡ�
��1����������ʱ������SO2�⣬���е���ɫ�������ɡ��÷�Ӧ�����ӷ���ʽΪBaS2O3+2H+=Ba2++S��+SO2��+ H2O��
��2����Һ����Ҫ�ɷ���BaCl2��NaCl��
��3����ת����������O2�뻹ԭ��SO32-�����ʵ���֮��Ϊ1��2��
��4������NaOH��Һ��Ŀ�����к��������ᣬ�����˹�������ԭ����2OH-+SiO2=SiO32-+H2O ��
��5������BaF2�ķ�Ӧ�Ļ�ѧ����ʽΪBaCl2+2NH4F=BaF2��+2NH4Cl��
�����÷�Ӧ�¶ȹ��ߣ��������c(F-)���͵�ԭ�����¶Ƚϸߴٽ�F-ˮ�⣬ʹc(F-)������
��������Һ��c(F-)=(0.22-0.2)/2mol��L-1=0.01 mol��L-1��c(Ba2+)= Ksp(BaF2)/ c2(F-)=1.0��10-6/0.012mol��L-1=0.01 mol��L-1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƻ����Ľṹ��ʽΪ�� ![]() ������˵����ȷ���ǣ� ��
������˵����ȷ���ǣ� ��
A.ƻ�����ܱ���������Ԫ����
B.1 molƻ�������3 mol NaOH�����кͷ�Ӧ
C.��1 molƻ�����ϡ��Һ����������Na��Ӧ����1.5molH2
D.2����ƻ�������Ӧ�����γɽṹΪ��Ԫ������Ԫ�����Ԫ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1 mol ���ۼ������յ��������γ�1 mol ���ۼ����ͷŵ�������Ϊ���ܡ���֪��H��H����Ϊ436 kJ /mol��H��N����Ϊ391 kJ /mol�� N2 (g)+ 3H2(g) ![]() 2NH3(g) ��H����92.4 kJ /mol������˵������ȷ����(����)
2NH3(g) ��H����92.4 kJ /mol������˵������ȷ����(����)
A. H��H��N��N���ι�
B. N��N����ԼΪ946 kJ/mol
C. �ϳɰ���Ӧѡ���ʵ��Ĵ�����Ϊ�����H2��ת����
D. 0.5 mol N2��1.5 mol H2����������³�ַ�Ӧ���ų�����Ϊ46.2 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������Ӧ��ʱ����ԭ���õ��ǣ� ��
A.���Ȼ�������ˮ��
B.�轺�������
C.Ư�۾���������
D.������ʳƷ���ڵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȩ(HCHO)�ڻ�����ҽҩ��ũҩ�ȷ����й㷺��Ӧ�á����ü�ȩһ��������ֱ��������Ƽ�ȩ����Ӧ����ʽ��CH3OH(g)![]() HCHO(g)+H2(g) ��H1
HCHO(g)+H2(g) ��H1
ʵ�������¶����ߣ�ƽ�ⳣ�����±���ʾ��
�¶�(K) | 500 | 700 | T1 | T2 | T3 |
ƽ�ⳣ�� | 7.13��10-4 | 3.30��10-1 | 2.00 | 9.00 | 10.00 |
��1����ȩ����������ԭ�˶��ﵽ�ȶ��ṹ����ȩ�ĵ���ʽΪ_____________��
��2�� ���ں��º�ѹ�����н���������Ӧ�����жϷ�Ӧ����ƽ��״̬����_______________��
A.���������ܶȲ���
B.CH3OH��HCHO�����ʵ���Ũ��֮��Ϊ1��1
C.H2������������ٸı�
D.��λʱ���ڼ�ȩ�������������������������
��3��T1ʱ��CH3OH��HCHO��H2 ��ʼŨ��(mol��L-1)�ֱ�Ϊ1.0��0.50 ��1.0����Ӧ�ﵽƽ��ʱ��HCHO ���������___________20% (����>������ =������ <��)��
��4����ҵ�ϲ���Ĥ������(���������кܸߵ�ѡ���Ժ�����)�����⣬װ������ͼ��Ϊ̽��ת���ʱ仯���ֱ�����ͨ��Ӧ����Ĥ��Ӧ���У��ı�ԭ����ѹǿ��������ͬ�¶ȣ�������ͬ��Ӧʱ�����ⶨ�״�ת������ʵ��������ͼ��
��A����v��______v��(����>������ =������ <��)��������____________��
��B���A��ת���ʸߵ�ԭ����_______________��

��5����ϵ�м���һ�������������ڼ�ȩ�����ɡ���Ӧ��ϵ�д������з�Ӧ��
CH3OH(g)+1/2O2(g)![]() HCHO(g)+H2O(g) ��H2
HCHO(g)+H2O(g) ��H2
H2(g)+12O2(g)![]() H2O(g) ��H3
H2O(g) ��H3
����H2����H3�Ĵ�С��ϵ����H2________��H3(����>������ =������ <��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ֽⷴӦ2N2O5��g��![]() 4NO2��g�� + O2��g�������ʷ���ʽv = k��cm��N2O5����k�����¶��йصij�����ʵ��ⶨ340Kʱ���й����ݼ������������������ͼ�����£�
4NO2��g�� + O2��g�������ʷ���ʽv = k��cm��N2O5����k�����¶��йصij�����ʵ��ⶨ340Kʱ���й����ݼ������������������ͼ�����£�
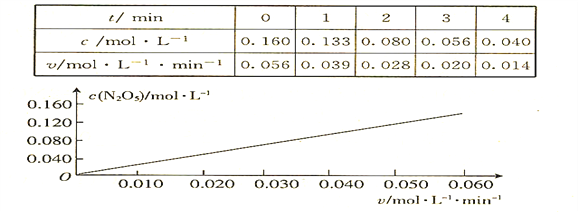
����ͼ���е��й���Ϣ���ж������й������в���ȷ����
A. 340Kʱ�����ʷ���ʽ�е�m = 1
B. 340Kʱ�����ʷ���ʽ�е�k = 0.350 min-1
C. 340Kʱ��c��N2O5��= 0.100 mol��l-1ʱ��v = 0.035 mol��l-1 ��min-1
D. 340Kʱ��ѹǿ����һ�����淴Ӧ���ʲ��䣬����Ӧ������ԭ����2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪:��![]() ��
��![]() ��
��![]() �ķ���ʽ��ΪC8H8������˵����ȷ����
�ķ���ʽ��ΪC8H8������˵����ȷ����
A. �٢ڢ۵����ȴ��������ȴ����ͬ���칹����Ŀ��ͬ
B. �٢ڢ۾���ʹ���Ը��������Һ������ѧ��Ӧ����ɫ
C. �ڷ���������ԭ��һ����ͬһƽ����
D. ����̼���ļۿ��ǣ��ٵ�ͬ���칹��ֻ�Тں͢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�У�������ˮ�ĵ��룬ֻ�����±�����ʾ���������ӣ����Ʋ�X���Ӽ������b����Ϊ�� ��
���� | Na+ | Al3+ | Cl�� | X |
���� | 2a | a | a | b |
A.NO3����2a
B.SO42����2a
C.OH����2a
D.SO42����4a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ��������ǣ� ��
A.������
B.������
C.������
D.��������������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com